Wir erklären, was ein Ion ist und wie es aufgebaut ist und einige Beispiele. Auch, was ist ein Anion und ein Kation.
¿ Was ist ein Ion?
In der Chemie ist ein Ion ein elektrisch geladenes Teilchen, das aus einem Atom oder Molekül besteht, das nicht elektrisch neutral ist, dh in seiner Konstitution Elektronen gewonnen oder verloren hat. Der Prozess, durch den Ionen erzeugt werden, wird „Ionisation“ genannt.
Ionen können aus zwei oder mehr Atomen (mehratomig) unterschiedlicher Natur oder aus einem einzelnen Atom (einatomig) bestehen. In beiden Fällen werden wir über ein Kation (oder Kationen) sprechen, wenn es ein positiv geladenes Ion ist (d. H., dass das anfängliche neutrale Atom oder Molekül Elektronen lieferte), und wir werden über ein Anion (oder Anionen) sprechen, wenn es ein negativ geladenes Ion ist (d. H., dass das anfängliche neutrale Atom oder Molekül Elektronen akzeptierte).
Aufgrund ihrer elektrischen Ladung sind auch andere Arten von Ionen bekannt, die als Dianionen (wenn sie zwei negative Ladungen aufweisen), Zwitterionen (wenn sie eine positive und eine negative Ladung aufweisen, die isoliert sind, aber in derselben Verbindung, weil sie neutral ist) oder ionische Radikale (Ionen von enormer Reaktivität und Instabilität, weil sie freie Elektronen haben). Im Allgemeinen sind Ionen hochreaktiv und neigen dazu, sich durch elektrostatische Wechselwirkungen mit anderen Ionen, Atomen oder Molekülen zu verbinden.
Ionen spielen eine unverzichtbare Rolle im Leben, insbesondere diejenigen von Kalzium, Kalium und Natrium, deren Bedeutung für den Transit von Zellmembranen und Neurotransmittern eingehend untersucht wurde. Darüber hinaus hat das Verständnis von Ionen es uns ermöglicht, die Plasmatechnologie zu entwickeln und sogar die Wasserqualität anhand der darin gelösten ionischen Salze zu messen.
Siehe auch: Chemische Bindung
Anion
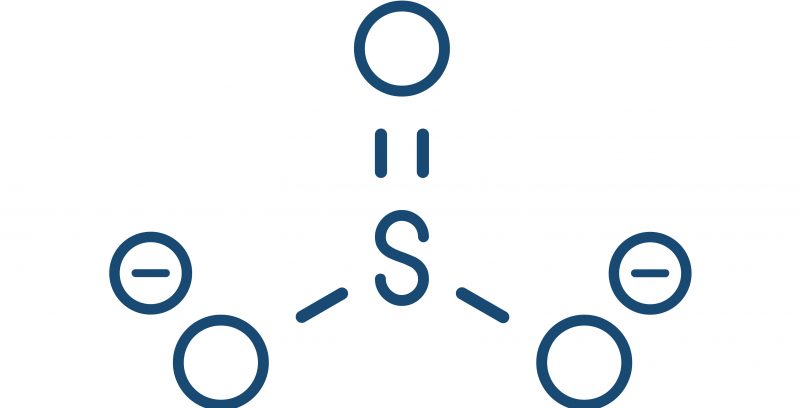
Anion (oder Anionen) ist ein Ion, das eine negative elektrische Ladung hat, dh es hat Elektronen in einer chemischen Reaktion gewonnen, die zu ihnen geführt hat. Sie können aus einem oder mehreren Atomen bestehen, aber auch im letzteren Fall ist die globale Ladung des Moleküls (seine Oxidationsstufe) immer negativ.
Es gibt drei Arten von Anionen:
- Einatomig. Diese bestehen aus einem einzigen Atom, das Elektronen gewonnen hat. Zum Beispiel: Chlorid (Cl -).
- Mehratomig. Sie stammen von einem Molekül, das in einer chemischen Reaktion Elektronen gewonnen hat, oder von einer Säure, die Protonen verloren hat. Zum Beispiel: Sulfit (SO32 -).
- Säuren. Sie stammen aus einer polyprotischen Säure (die mehrere ionisierbare Wasserstoffatome aufweist), aus der Protonen extrahiert wurden. Zum Beispiel: Diacid Phosphat (H2PO4 -).
Kation
Kationen sind Ionen, die eine positive elektrische Ladung haben, dh sie haben ein oder mehrere Elektronen verloren. So können Kationen wie Anionen auch aus einem oder mehreren Atomen bestehen, sofern die Gesamtladung der Verbindung in diesem Fall positiv ist.
Eine der wichtigsten Funktionen von Kationen ist ihre Beteiligung an biologischen Prozessen. Beispielsweise spielen Na + – und K + -Kationen eine Schlüsselrolle bei der Übertragung von Nervenimpulsen.
Beispiele für Ionen

Die bekanntesten Ionen sind:
- Einfache Kationen. Bestehend aus einem einzelnen Atom mit einer positiven Ladung:
- Aluminium (Al3+)
- Cäsium (Cs+)
- Chrom (III) oder Ion Chrom (Cr3+)
- Chrom (VI) oder ion percrómico (Cr6+)
- Wasserstoff oder Proton (H+)
- Helium oder Alphateilchen (He2+)
- Lithium (Li+)
- Eisen (II) -Ionen Eisen (Fe2+)
- Eisen (III) oder Eisen (Fe3+)
- Nickel (III) oder Ionen niquélico (Ni3+)
- Zinn (II) oder Ionen estanoso (Sn2+)
- Zinn (IV) oder ion estánico (Sn4+)
- Kation mehratomig. Bestehend aus zwei oder mehr positiv geladenen Atomen:
- Ammonium (NH4+)
- Oxonium (H3O+)
- Nitronium (NO2+)
- Quecksilber (I) oder Quecksilberion (Hg22+)
- Einfache Anionen. Bestehend aus einem einzelnen Atom mit negativer Ladung:
- Azid (N3–)
- Bromid (Br–)
- Carbid (C4-)
- Chlorid (Cl–)
- Fluorid (F–)
- Phosphid (P3-)
- Nitrid (N3-)
- Sulfid (S2-)
- Oxoanione. Bestehend aus Sauerstoff und anderen Elementen, haben negative Ladung:
- Arsenat (AsO43-)
- Borat (BO33-)
- Hipobromito (BrO–)
- Bicarbonat (HCO3–)
- Chlorat (ClO3–)
- Chlorit (ClO2–)
- Hypochlorit (ClO–)
- Dichromat (Cr2O72-)
- Hidrógenosulfato oder Bisulfat (HSO4–)
- Hidrógenosulfito oder Bisulfit (HSO3–)
- Silikat (SiO44-)
- Anionen organischer Säuren. Von organischen Molekülen kommend, haben negative Ladung:
- Acetat (C2H3O2-)
- Oxalat (C2O42-)
- Bioxalat (HC2O4–)
- Anderen Anionen. Mit negativer Ladung und dem größten Teil eines Atoms:
- Bisulfid (HS-)
- Amiduro (NH2–)
- Cyanat (OCN-)
- Thiocyanat (SCN–)
- Cyanid (CN–)
- Hydroxid (OH–)
Letzte Änderung: Dezember 12, 2020. Wie zu zitieren: „Ion“. Autor: María Estela Raffino. Aus: Argentinien. Zu: Concepto.de . Verfügbar unter: https://concepto.de/ion/. Abgerufen: März 26, 2021.