Abstract
Sfondo
Congenita astragalo verticale è definito come una deformità del piede in cui il calcagno è in equinus, l’astragalo è plantarflexed, e c’è una rigida e irriducibile dislocazione del talonavicular articolazione complessa, con lo scafoide articolare su dorsolateral aspetto del talar collo. È spesso associato al coinvolgimento sistemico.
Mira
a identificare le più comuni anomalie che accompagnano il CVT (Congenita Vertical Talus). Nella revisione della letteratura non è stata trovata alcuna letteratura che studiasse dati clinici simili.
Progettazione dello studio
La CVT ha un effetto sistemico ed è accompagnata da molte anomalie. Contemporaneamente a questo studio, sono state frequentemente riscontrate anomalie che accompagnano la CVT. Lo scopo di questo studio è valutare i risultati clinici prenatali, natali e postnatali associati all’astragalo verticale congenito.
Metodi
Tra il 2012 e il 2018, nello studio sono stati inclusi un totale di 20 pazienti con CVT (12 maschi, 8 femmine). Sono stati inclusi i bambini di età compresa tra 0 e 18 che hanno fatto domanda alla clinica di dismorfologia per lo studio.
Risultati
In questo studio sono stati rilevati cinque parametri associati alla CVT. Questi includono ritardo della crescita intrauterina, storia di nascita ipossica, ipotonia, microcefalia e criptorchidismo.
Conclusione
È necessario un approccio dettagliato e multidisciplinare alla CVT.
Parole chiave
Microcefalia, astragalo verticale, Ritardo della crescita intrauterina
Introduzione
L’astragalo verticale congenito è raro. Il primo studio clinico, anatomico, patologico e roentgenografico di questa condizione fu pubblicato da Henken, nel 1914. Un astragalo verticale congenito, noto anche come pes valgo convesso congenito, è una rara deformità del piede caratterizzata da una dislocazione dorsale fissa nella testa talare e nel collo navicolare. Si stima che l’incidenza sia una su 10.000. Circa la metà di tutti i casi (idiopatici) sono associati a deformità e 2-5 disturbi neuromuscolari e genetici nei restanti casi. Ci sono prove che alcune deformità isolate sono trasmesse come una caratteristica autosomica dominante con penetranza incompleta . La deformità è anche conosciuta dal piede piatto congenito “rocker-bottom” a causa della sua deformità rigida con l’avampiede dorsiflesso e il plantare plantare posteriore. Anche il termine “pes valgo convesso congenito” è spesso usato. Per fare una diagnosi definitiva, è importante dimostrare che il navicolare è dislocato dorsalmente sul collo dell’astragalo quando il piede viene mantenuto in estrema flessione plantare . L’astragalo verticale congenito è caratterizzato da equino posteriore, valgo posteriore, abduzione dell’avampiede e dorsiflessione dell’avampiede all’articolazione midtarsale. Questo di solito è riconosciuto nel periodo neonatale dalla rigidità delle deformità, ma deve essere differenziato dal più comune piede calcaneovalgus, dall’arco mediale posteriore della tibia e dal piede piatto flessibile. Nell’astragalo verticale congenito, la superficie plantare del piede è convessa creando un aspetto rocker-bottom .
La dismorfologia consente l’identificazione di forme umane non normative prima e dopo la nascita che consentono l’identificazione e la classificazione di varie malformazioni congenite. Questo termine fornisce una descrizione comparabile che tutte le caratteristiche del corpo (statura, piedi, mani, collo) e viso (come forma della testa, lunghezza del naso, posizione delle orecchie, spessore del vermiglio, ecc.) di individui che hanno la stessa fascia di età e la stessa etnia. Un’eziologia genetica dovrebbe essere sospettata se un bambino ha una visione dismorfica con una di queste caratteristiche: (a) anomalie congenite; (b) Ritardo della crescita; (c) Ritardo dello sviluppo e disabilità intellettiva o regressione dello sviluppo; (d) Caratteristiche sessuali secondarie non sviluppate; (e) Genitali ambigui .
L’esatta eziologia dell’astragalo verticale nella maggior parte dei casi non è nota. Le teorie includono l’aumento della pressione intrauterina e le conseguenti contratture tendinee, o un arresto nello sviluppo fetale che si verifica tra la 7a e la 12a settimana di gestazione .
Le anomalie genetiche associate all’astragalo verticale includono l’aneuploidia dei cromosomi 13, 15 e 18. Sono state descritte anche una varietà di sindromi in cui l’astragalo verticale è una manifestazione clinica. La sindrome di De Barsy è una rara sindrome genetica caratterizzata da grave cutis laxa, ipermobilità articolare, ritardo della crescita, ritardo mentale e facies caratteristiche; le manifestazioni ortopediche includono lussazione dell’anca, scoliosi e astragalo verticale congenito .
Restrizione intrauterina della crescita (IUGR) rischio di ritardo della crescita. Deriva dal fatto che il feto non cattura il potenziale di crescita determinato a causa di disturbi anatomici e/o funzionali .
La circonferenza della testa fornisce informazioni approssimative sul volume intracranico. La misurazione della circonferenza della testa è un metodo di calcolo indiretto e semplice utilizzato per determinare se la crescita del cervello progredisce normalmente. La crescita intorno alla testa è molto importante per lo sviluppo del cervello .
L’ipotonia si riferisce a una compromissione che può essere associata a molte condizioni diverse, comprese quelle di origine neuromuscolare, genetica, del sistema nervoso centrale, del tessuto connettivo e/o metabolica . Clinicamente, il tono muscolare viene valutato valutando la resistenza allo stretching passivo, mentre l’ipotonia è definita come una riduzione del tono muscolare. Si pensa che la contrazione muscolare e la rigidità muscolare, tendinea e dei tessuti molli contribuiscano al tono muscolare. La patologia del meccanismo del riflesso di tensione e la riduzione dell’eccitabilità del pool di motoneuroni segmentali sono state suggerite come base fisiologica per l’ipotonia .
Il criptorchidismo è l’assenza di almeno un testicolo nello scroto (Figura 1). L’incidenza del criptorchidismo è alta e quasi il 3% dei ragazzi nei paesi occidentali viene operato per questa condizione. Le anomalie nell’asse ipotalamo-ipofisi-testicolare possono provocare il criptorchidismo e il criptorchidismo è quasi quasi presente in individui con un testicolo e una differenziazione sessuale anormale .
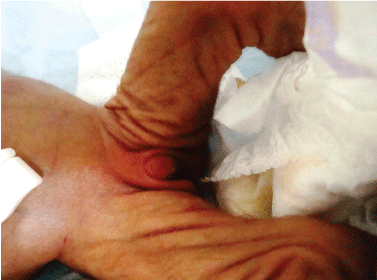 Figura 1: Trisomia 18 (sindrome di Edward) bambini con criptorchidismo. Visualizza figura 1
Figura 1: Trisomia 18 (sindrome di Edward) bambini con criptorchidismo. Visualizza figura 1
È stata studiata la presenza di una storia di nascita ipossica nel periodo postnatale. A tale scopo, è stato studiato il punteggio APGAR di nascita dei pazienti. Allo stesso tempo, questi pazienti sono stati seguiti a lungo nella clinica genetica medica. Soprattutto se l’ipotonina era presente o meno. Sono stati studiati i tempi dello sviluppo motorio, dello sviluppo del linguaggio e delle fasi di sviluppo sociale.
Il punteggio APGAR utilizzato per il benessere fetale è un altro parametro che abbiamo messo in discussione. Questo punteggio include colore, frequenza cardiaca, riflessi, tono muscolare e respirazione. Ci sono 3 categorie in base ai risultati del punteggio APGAR; basso (0-3); intermedio (4-6) e normale (7-10). I punteggi bassi di Apgar alla nascita sono costantemente associati ad un aumentato rischio di malattie neurologiche, come paralisi cerebrale, epilessia e deterioramento cognitivo .
Materiali e metodi
Tra il 2012 e il 2018, nello studio sono stati inclusi un totale di 20 pazienti con CVT (12 maschi, 8 femmine).
Le cartelle cliniche dei pazienti sono state esaminate in dettaglio e sono state identificate le anomalie associate alla CVT. I registri dei pazienti del periodo prenatale sono stati scansionati. Qui, le caratteristiche fetali sono state studiate nel periodo prenatale. Movimenti fetali, oligoidramnios, polidramnios, ritardo della crescita intrauterina. Inoltre, sono state studiate complicanze materne come ipertensione, diabete, preeclampsia.
Sono stati studiati tre parametri relativi al turnover natale dei pazienti. Stile di nascita, peso alla nascita e tempo di nascita. Se il tipo di parto cesareo è stato preferito, la ragione di ciò è stata studiata.
I dati raccolti sono stati analizzati dal Pacchetto statistico per le scienze sociali versione 18.0 (SPSS Inc., SPSS IBM, Armonk, NY, Stati Uniti d’America). I dati continui sono stati espressi come media ± deviazione standard (intervallo: minimo-massimo) mentre i dati categoriali sono stati indicati come numeri o percentuali, se del caso. Il test Chi-quadrato è stato utilizzato per i confronti statistici. Valori di p a due code inferiori a 0,05 sono stati accettati per essere statisticamente significativi.
Risultati
Nello studio, le comorbidità più comuni sono state riscontrate nei pazienti con CVT.
IUGR (ritardo della crescita intrauterina) è stato rilevato in 16 pazienti su 20 (80%) nel periodo prenatale. Hanno ricevuto la diagnosi IUGR alla 20a settimana durante la gravidanza. Il peso medio alla nascita dei bambini è di 1980 gr.
In totale 12/20 pazienti, punteggio APGAR al 5 ° minuto era tra 4-7 (Lieve trauma ipossico nascita) Il punteggio APGAR a 4/12 è stato trovato per essere inferiore a 4. (Grave trauma ischemico ipossico alla nascita.) Questi 4 pazienti sono stati seguiti a lungo nell’unità di terapia intensiva neonatale.
La circonferenza cranica dei pazienti è stata seguita per 2 anni dalla nascita. Di conseguenza, la microcefalia è stata rilevata alla nascita in 12/20 pazienti. La circonferenza cranica media di questi pazienti era di 33 cm. è stato riscontrato che i pazienti che avevano microcefalia alla nascita erano allo stesso modo microcefalia a 2 anni di età.
Quando i record di questi pazienti sono sottoposti a screening, è l’altra scoperta che l’ipotonia è presente nella metà di questi risultati (10/20 pazienti).
Il criptorchidismo è stato rilevato in 8 dei 12 pazienti maschi. Il criptorchidismo rilevato era bilaterale.
Inoltre, l’analisi cromosomica in 20 pazienti ha rivelato trisomia 18 in 6 pazienti (Figura 2 e Figura 3). I risultati cromosomici dei restanti 14 pazienti sono stati riportati come normali.
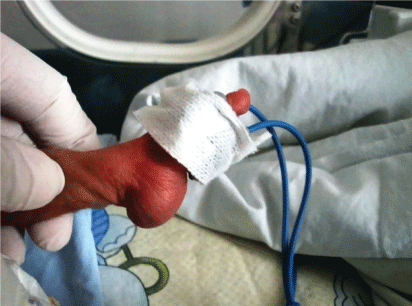 Figura 2: Trisomia 18 (sindrome di Edward) bambini con astragalo verticale del piede sinistro. Visualizza figura 2
Figura 2: Trisomia 18 (sindrome di Edward) bambini con astragalo verticale del piede sinistro. Visualizza figura 2
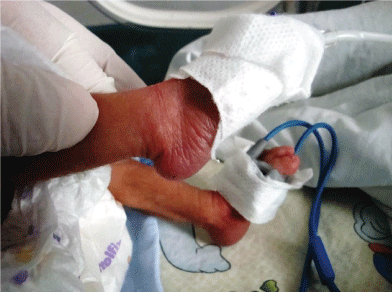 Figura 3: Trisomia 18 (sindrome di Edward) bambini con astragalo verticale del piede destro. Visualizza figura 3
Figura 3: Trisomia 18 (sindrome di Edward) bambini con astragalo verticale del piede destro. Visualizza figura 3
Discussione
Non è stato trovato alcun articolo in letteratura che indaghi su dati clinici simili. Pertanto, è difficile confrontare i dati dei nostri pazienti con la letteratura.
In letteratura non sono state trovate informazioni sul ritardo della crescita intrauterina nei casi di CVT. Nello studio condotto da Romo, et al. Nel 2009, l’incidenza di IUGR nella popolazione generale è stata trovata tra il 3% e il 7% . Rispetto alla popolazione generale e ai pazienti con CVT, il tasso di IUGR è stato molto più alto (80%) nei pazienti con CVT.
Secondo i nostri risultati in questo studio, le anomalie neurologiche nei pazienti con CVT possono essere suddivise in 2 categorie principali. Questi sono: malattie del sistema nervoso centrale e malattie neuromuscolari (la frequenza di entrambi è stata trovata uguale).
Ci sono pochissime pubblicazioni in letteratura che riportano la relazione criptorchidismo con CVT. L’astragalo verticale e il criptorchidismo sono comuni in più casi di sindrome da pterigio .
In uno studio condotto da Merrill e colleghi, il 36% dei pazienti con CVT aveva una malattia neuromuscolare (come paralisi cerebrale, Mielomeningocel, sindrome di regressione caudale, idrocefalo) . Le anomalie cerebrali fetali sono la scoperta più comune associata all’astragalo verticale congenito, che si verifica nel 63% dei nostri casi. Le condizioni anormali erano generalmente gravi e includevano microcefalia, anomalie migratorie, sottosviluppo del cervello, del cervelletto e del cervelletto oltre alla malformazione di Chiari II associata a mielomeningocele. Mentre utile nel valutare USG a crescita della testa, MRI ha trovato un aiuto importante nell’identificazione delle anomalie cerebrali, in particolare anomalie di migrazione e sulcation .
Il 46% dei pazienti in questo studio presenta anomalie spinali come scoliosi, mielomeningocele e cavo legato. Sebbene le malformazioni della colonna vertebrale possano essere facilmente viste dall’USG, la posizione del cordone e del cono viene valutata meglio con la risonanza magnetica .
È stato associato a CVT e trisomia 13, 15 e 18. 25% dei pazienti nello studio di Rubio, et al. aveva anomalie cromosomiche che è trisomia 18 (anomalia cromosomica più comune in questo studio.). Ciò è in linea con gli studi precedenti che descrivono un’associazione del piede inferiore del rocker e dell’aneuploidia della trisomia 13, 15 e 18 . Nel nostro studio, le anomalie cromosomiche erano la trisomia 18 che abbiamo rilevato al più comune. Abbiamo trovato la trisomia 18 in 6 pazienti su 20 in totale (30%).
Conclusione
In questo studio, 5 parametri sono stati trovati frequentemente associati a casi di CVT. Questi parametri; ritardo della crescita intrauterina, anamnesi ipossica, ipotonia, microcefalia e criptorchidismo. L’astragalo verticale è una malattia multi-sistemica ed è necessario un approccio multidisciplinare. I casi di talus verticale dovrebbero essere studiati in dettaglio per i risultati del periodo prenatale, natale e postnatale.
- Ogata K, Schoenecker PL, Sheridan J (1979) Astragalo verticale congenito e sua presenza familiare: un’analisi di 36 pazienti. Clin Orthop Relat Res 128-132.
- Hack M, Breslau N, Weissman B, Aram D, Klein N, et al. (1991) Effetto del peso alla nascita molto basso e delle dimensioni della testa subnormale sulle capacità cognitive in età scolare. N Engl J Med 325: 231-237.
- Lloyd Roberts GC, Spence AJ (1958) Astragalo verticale congenito. J Bone Giunto Surg Br 40: 33-41.
- Dobbs MB, Purcell DB, Nunley R, Morcuende JA (2006) Primi risultati di un nuovo metodo di trattamento per l’astragalo verticale congenito idiopatico. J Bone Giunto Surg Am 88: 1192-1200.
- Coleman SS, Stelling III FH, Jarrett J (1970) Patomeccanica e trattamento dell’astragalo verticale congenito. Clin Orthop Relat Res 70: 62-72.
- Hamanishi C (1984) Astragalo verticale congenito: classificazione con 69 casi e nuovo sistema di misurazione. J Pediatr Orthop 4: 318-326.
- Alaee F, Boehm S, Dobbs MB (2007) Un nuovo approccio al trattamento dell’astragalo verticale congenito. J Bambino Orthop 1: 165-174.
- Hunter AGW (2002) Genetica medica: 2 L’approccio diagnostico al bambino con segni dismorfici. CMAJ 167: 367-372.
- Featherstone K, Latimer J, Atkinson P, Pilz DT, Clarke A (2005) Dismorfologia e lo spettacolo della clinica. Sociol Guarire Illn 27: 551-574.
- Wallenstein MB, Harper LM, Odibo AO, Roehl KA, Longman RE, et al. (2012 Cardiopatia congenita fetale e restrizione della crescita intrauterina: uno studio di coorte retrospettivo. J Matern Med neonatale 25: 662-665.
- Salam RA, Das JK, Bhutta ZA (2014) Impatto della restrizione della crescita intrauterina sulla salute a lungo termine. Curr Opin Clin Nutr Metab Cura 17: 249-254.
- GravesAB, Mortimer JA, Larson EB, Wenzlow A, Bowen JD, et al. (1996) Circonferenza della testa come misura della riserva cognitiva. Associazione con gravità della compromissione nella malattia di Alzheimer. Br J Psichiatria 169: 86-92.
- Sacco R, Militerni R, Frolli A, Bravaccio C, Gritti A, et al. (2007) Correlati clinici, morfologici e biochimici della circonferenza della testa nell’autismo. Biol Psichiatria 62: 1038-1047.
- Associazione americana di terapia fisica. Sezione su Pediatria. Terapia fisica pediatrica: La gazzetta ufficiale della sezione sulla pediatria dell’American Physical Therapy Association. Il film è stato prodotto da Wil
- Cortes D (1998) Criptorchidismo aspects aspetti di patogenesi, istologia e trattamento. Scand J Urol Nephrol Suppl 196: 1-54.
- Tweed EJ, Mackay DF, Nelson SM, Cooper SA, Pell JP (2016) Punteggio Apgar di cinque minuti e risultati educativi: studio di coorte retrospettivo su 751.369 bambini. Arch Dis Bambino Fetale neonatale Ed 101: 121-126.
- (2006) Il punteggio Apgar. Adv Assistenza neonatale 6: 220-223.
- Romo A, Carceller R, Tobajas J (2009) Ritardo di crescita intrauterino (IUGR): epidemiologia ed eziologia. Pediatr Endocrinol Rev 3: 332-336.
- Konya MN, Elmas M, Özdemir Ç (2017) Analisi delle anomalie dismorfiche muscoloscheletriche di 20 feti. Eklem Hastalik Cerrahisi 28: 114-120.
- Chen H, Chang CH, Misra RP, Peters HA, Grijalva NS, et al. (1980) Sindrome da pterigio multiplo. Am J Med Genet 7: 91-102.
- Merrill LJ, Gurnett CA, Connolly AM, Pestronk A, Dobbs MB (2011) Anomalie dei muscoli scheletrici e fattori genetici legati all’astragalo verticale. Clin Orthop Relat Res 469: 1167-1174.
- Rubio EI, Mehta N, Blask AR, Bulas DI (2017) Astragalo verticale congenito prenatale (piede inferiore a bilanciere): un marker per anomalie multisistemiche. Pediatr Radiol 47: 1793-1799.
Citazione
Muhsin E (2018) Anomalie comuni associate all’astragalo verticale congenito: un’esperienza a centro singolo. Int J Piede caviglia 2: 013. doi.org/10.23937/ijfa-2017/1710013