- Hypophosphorous kyselina Chemické Vlastnosti,Použití,Výroba
- Osnova
- chemické vlastnosti
- používá
- toxicita
- identifikace nebezpečí
- způsob přípravy
- Výrobní metody
- popis
- popis
- Chemické Vlastnosti
- Fyzikální vlastnosti
- používá
- Definice
- přípravek
- výrobní metody
- definice
- reakce
- obecný popis
- Vzduch & Reakce Vody
- reaktivita
- nebezpečí
- zdravotní riziko
- nebezpečí požáru
- metody čištění
Hypophosphorous kyselina Chemické Vlastnosti,Použití,Výroba
Osnova
Hypophosphorous kyselina je známá také jako „hypophosphite“ je To bezbarvý olej nebo deliquescence crystal , to je důležitý v pořádku chemický výrobek. Hlavní použití je jako redukční činidlo pro electroless pokovování, fosforečné se zabránilo zabarvení pryskyřice, to může být také použit v esterifikace reakce, katalyzátor, chladiva, zejména pro výrobu vysoce čistého produktu sodíku hypophosphite. Existuje několik způsobů přípravy, běžnou průmyslovou metodou pro výrobu je metoda iontoměničové pryskyřice a metoda elektrodialýzy.
chemické vlastnosti kyseliny fosforečné, použití, toxicita a výrobní metody jsou editovány andy z Chemicalbook. (2016-12-04)
chemické vlastnosti
jedná se o průsvitné krystaly nebo bezbarvý olej. Teplota tání: 26,5℃. Relativní hustota (měrná hmotnost): 1.439 (pevná látka, 19℃). Je rozpustný ve vodě, ethanolu a etheru a může být smíchán v jakémkoli poměru s vodou, ethanolem, acetonem. Ve vzduchu se snadno rozkládá na sirupovou kapalinu a vodný roztok je kyselý.
Hypophosphorous kyselina je jednomocných kyselina, ve vodném roztoku, Hypophosphorous kyselina je silná kyselina, Ka = 10-2 (25℃); je relativně stabilní při pokojové teplotě; disproporcionace reakce může pokračovat na 130℃, rozložit do fosfin a fosforu kyseliny:
2H3PO2=H3PO4+PH3
má silnou redukcí, heavy metal roztok soli může být obnovena s kovy jako Cu2 +, Hg2 +, Ag +, jako:
4Ag+H3PO2+2H2)=4Ag+H3PO4+4H+
To je slabé oxidační činidlo, může být snížena na fosfin, fosfin, když narazí na silný redukční činidlo.
používá
1. Kyselina fosforečná se používá jako redukční činidlo pro galvanické pokovování;
2. Může být použit k zabránění zabarvení pryskyřice kyseliny fosforečné;
3. Používá se jako esterifikační katalyzátor, chladivo;
4. Používá se k výrobě hypofosfitu, sodné soli, manganové soli, soli železa se obecně používají jako výživné látky;
5. Kyselina fosforečná se používá v medicíně a jako redukční činidlo, stanovení arsenu, teluru a separace tantalu, niobu a dalších činidel.
6. Je to silné redukční činidlo, může být použito k přípravě hypofosforečnanu sodného, fosforečnanu vápenatého a jiného hypofosforečnanu.
7. Může být použit pro pokovování lázně. Léčivo. redukční činidlo. obecná činidla.
8. Je to silné redukční činidlo, může být použito při výrobě hypofosforečnanu sodného, fosforečnanu vápenatého a dalších hypofosforečnanů.
9. Tento produkt je široce používán jako redukční činidlo, Ag, Cu, Ni, Hg a další kovy jsou redukovány na odpovídající kovové, pro ověření, Jak, Nb, Ta a další činidla, mohou být použity pro přípravu Na, K, Ca, Mn, Fe a jiné typy hypophosphite.
toxicita
je nehořlavý. Ale při kontaktu s otvorem H agenta, to způsobí požár. Když se setká s oxidačním činidlem, může dojít k násilné reakci a spalování. Když se zahřeje na vysokou teplotu, může se rozložit na vysoce toxický fosfinový plyn nebo dokonce explodovat. Je žíravý. Kyselina hypofosforečná se často přidává do nealkoholických nápojů a protože není absorbována. Riziko je tedy malé, ale zvláště silné hypofosfitové poškození gastrointestinálního traktu. Náhodně stříká do očí nebo se dotýká pokožky, k mytí se používá velké množství vody. Provozovatelé výroby by měli nosit ochranný oděv a další ochranný oděv. Výrobní zařízení by mělo být utěsněno, dílna by měla být dobře větrána.
identifikace nebezpečí
prohlášení o nebezpečnosti:
způsobuje těžké poleptání kůže a poškození očí.
způsobuje vážné poškození očí
bezpečnostní pokyny:
Nevdechujte prach/kouř/plyn/mlhu/páry / sprej.
po manipulaci důkladně omyjte.
používejte ochranné rukavice a ochranu očí/obličeje.
při požití: Vypláchněte ústa. Nevyvolávejte zvracení.
při styku s pokožkou (nebo vlasy): veškerý kontaminovaný oděv okamžitě sundejte/sundejte. Opláchněte pokožku vodou / sprchou.
při zasažení očí: několik minut opatrně opláchněte vodou. Odstraňte kontaktní čočky, pokud jsou
přítomné a snadno proveditelné. Pokračujte v opláchnutí.
při vdechnutí: vyjměte oběť na čerstvý vzduch a udržujte ji v klidu v poloze pohodlné pro dýchání.
okamžitě volejte toxikologické středisko nebo lékaře / lékaře.
obchod uzamčen.
zlikvidujte tento materiál a jeho nádobu na sběrné místo nebezpečného nebo zvláštního odpadu.
způsob přípravy
1. Fosfor a hydroxid barnatý, roztok se zahřeje, barnaté soli Ba (H2PO2) 2 • 2H2O může generovat, kyselina sírová se přidává do hypophosphorous kyseliny roztok barya, Ba2+ může uspíšit:
Ba(H2PO2)2+H2SO4=BaSO4+2H3PO2
Hypophosphorous kyseliny mohou být získány odpařením za sníženého tlaku a nízké teplotě krystalizace. V důsledku tohoto procesu, rozpustnost soli barya je malý, takže koncentrace získané Hypophosphorous kyselin není vysoká, průmyslový výrobek by měl být čištěn rekrystalizací.
2. na oxidu barnatého (nebo vápna) a roztok bílý fosfor je vyhřívaný dohromady, aby vytvořily sekundární fosforečnan barnatý (nebo vápník), a pak reaguje s kyselinou sírovou, to je filtrován, soustředila na získání produktu, nebo sodík hypophosphite řešení výnosy H-typ iontoměničové pryskyřice, které lze odvodit produktu. Tato metoda vyžaduje velké množství pryskyřice a pryskyřice regenerace a promytí je těžkopádné, to obvykle stojí více než 7 dolarů za libru, to je vhodné pouze pro malosériovou výrobu, a není vhodný pro rozsáhlé průmyslové aplikace.
3. Hypophosphorous kyselina je připravena elektrodialýzou metoda, přičemž kterých buňka se dělí do tří částí, které jsou anodové komory, suroviny komory a katodové komory, prostřední je oddělena aniontové kationtové membrány a membrány, mezi dvě membrány sodíku hypophosphite řešení je umístěn (koncentrace 100 g/L~500g/L), anodová komora je zředěný roztok Hypophosphorous kyseliny 5 g/L, anodové komoře je zředěný roztok hydroxidu sodného ( 5g /L), mezi póly DC (3V~36V) je předán, anoda uvolňuje kyslík, a generuje sekundární produkt Hypophosphorous kyseliny; katodě uvolňuje vodík a vytváří sekundární produkt hydroxid sodný, reakční doba je 3~21h. Reakce z anodové komory a katodové komory jsou následující:
anodové komory:
H2O==H++OH-
2OH-==O2+2H2O+4e
H++H2PO2-==H3PO2
katodové komory:
H2O==H++OH-
2H++2e==H2
Na++OH-==NaOH
Kterých je způsob přípravy Hypophosphorous kyselina je jednoduché a zařízení investice je malý, je vhodný pro masovou výrobu.
4. Od průmyslové třídy chlorid hypophosphite, Cl-, SO42-anionty, které mají vliv na kvalitu ukazatele Hypophosphorous kyseliny jsou odstraněny srážením, ionty těžkých kovů jsou odstraněny z roztoku tím, že tvoří sulfid, a pak pomocí silně kyselá katexová pryskyřice získat sodný sekundární fosfáty, vysoký stupeň čistoty produktu můžete získat. Proces může produkovat high-grade sekundární fosfáty, technicky je proveditelné, tento proces je jednoduchý, snadné ovládání, dobrou kvalitu výrobku, to může uspokojit potřeby elektronického průmyslu, obranného průmyslu a dalších high-tech oborů.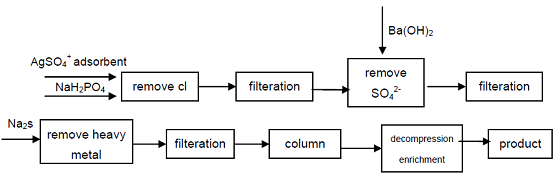
obrázek 1 Výrobní Proces Hypophosphorous Kyseliny z Průmyslových Sodíku Hypophosphite.
5. Iontová výměna pryskyřice metoda: cca 70 g katexová pryskyřice ve styku s vodou je balena do skleněné zkumavky s 5 mol/L kyseliny chlorovodíkové v oběhu asi 15 minut, poté důkladně omýt vodou, vysoce čistý vodný roztok hypophosphite vodný roztok (15 g/60 ml H2O) teče přes to, pryskyřice sloupci je nejprve promyje 50 ml, pak s 25 rni destilované vody. Odpadní kyselina a promývání se kombinují, koncentrují se odpařením ve vodní lázni. Koncentrovaná kyselina se umístí do vysokého vakua se sušičkou P205 pro dehydrataci, chlazení a krystalizaci, filtraci, rekrystalizaci, pro získání produktu kyseliny hypofosforečné.
Výrobní metody
Iontová výměna pryskyřice metoda: dát asi 70 g vody-rozpustné katexová pryskyřice vyplnit do skleněné trubice. Cirkulujte s 5 mol/L kyselinou chlorovodíkovou po dobu asi 15 minut a dostatečně promyjte vodou. Mají vysokou vodným roztokem hypophosphite řešení (15 g/60 ml H2O) průtok pryskyřice sloupec, následovaný být promyje nejprve s 50 ml vody, a pak opláchnutí 25 rni destilované vody. Odpadní kyselina a výplachy byly kombinovány a koncentrovány odpařením na vodní lázni. Koncentrovaná kyselina se odešle do vysoce Vakuové sušičky P205 pro dehydrataci, následované ochlazením krystalizace, filtrace a rekrystalizace, aby se získal konečný produkt kyseliny fosforečné.
popis
kyselina Hypofosforečná je silné redukční činidlo s molekulárním vzorcem H3PO2. Anorganičtí chemiciodkazují na volnou kyselinu tímto názvem, i když její název IUPACname je dihydridohydroxidooxidofosfor, nebopřijatelný název kyseliny fosfinové. Je to bezbarvá sloučenina s nízkou teplotou tání, která je rozpustná ve vodě, dioxanu a alkoholech. Vzorec pro hypofosforukyselina je obecně psána H3PO2, ale popisnější prezentací je HOP (O) H2, který zvýrazňujejeho monoprotický charakter. Soli získané z této kyselinyjsou nazývány fosfináty (hypofosfity).
popis
tato kyselina má obecný vzorec h4p2o6 a liší se od ostatních kyslíko-fosforečných kyselin. Má mnoho peculiarities.It vzniká spolu s fosforem a fosforečnemkyseliny, když je fosfor oxidován vlhkým vzduchem.Pokud je bílý fosfor vystaven vzduchu a acetát sodnýdo kapalinykteré tvoří, poněkud nerozpustnéhypofosfát sodný, Na2H2P2O6 * 6h2oseparáty. Monohydrát hypofosforečnanu sodného je však velmirozpustný a rozpustný při ~98,7 g / 100 ml.
Chemické Vlastnosti
bezbarvá tekutina
Fyzikální vlastnosti
Bezbarvé hygroskopické krystaly nebo olejovitá kapalina; kyselý zápach; hustota 1.493 g/cm3, taje při 26.5°C, vře při teplotě 130°C, velmi snadno rozpustná ve vodě, alkoholu a éteru; hustota 50% vodný roztok je 1.13 g/mL.
používá
přípravu hypofosfitů, galvanické lázně.
Definice
ChEBI: fosfor oxokyselinou, že se skládá z jednoho pentavalentní fosforu kovalentně vázány prostřednictvím jednoduché vazby se dvěma vodíky a hydroxy skupiny a přes dvojnou vazbu ke kyslíku. Rodič třídy fosfinových kyselin.
přípravek
kyselina fosforečná může být připravena různými způsoby:
1. Vroucí bílý fosfor s hydroxidem vápenatým:
P4 + 4Ca (OH)2 + 8H2O → 4Ca (H2PO2) 2 + 4H2
vápenatá sůl je rozpustná ve vodě. Ošetření s kyselinou sírovou výnosy thehypophosphorous kyseliny:
(H2PO2)2Ca + H2SO4 → 2H3PO2 + CaSO4
výrobek směs se filtruje k odstranění nerozpustný CaSO4. Vodné rozpouštění kyseliny fosforečné se koncentruje za sníženého tlaku.Místo hydroxidu vápenatého lze použít koncentrovanou vodu baryta.2. Zpracováním hypofosforečnanu sodného Nah2po2s iontoměničovou pryskyřicí.Sodná sůl se může vyrábět vařením bílého fosforu s roztokem hydroxidu sodného, což je reakce podobná (1) výše.
PH3 + 2I2 + 2H2O → H3PO2 + 4HI
výše uvedená metoda může být považována za bezpečnější než metoda zahrnující zahřívání bílého fosforu zásadou.
kyselina fosforečná musí být skladována při teplotě do 50°C. prodává se komerčně jako vodný roztok v různých koncentracích.
výrobní metody
kyselina Hypofosforečná vzniká reakcí hypofosforečnanu barnatého a kyseliny sírové a filtrací síranu barnatého. Odpařením roztoku ve vakuu při 80 °C, a poté chlazení na 0°C, hypophosphorous kyselina krystalizuje.
definice
bílá krystalická pevná látka. Jedná se o kyselinu monobázovou tvořící anion H2PO2-ve vodě. Sodná sůl, a tím i kyselina, se může připravit zahřátím žlutého fosforu roztokem hydroxidu sodného. Volná kyselina a její soli jsou silnými redukčními činidly.
reakce
kyselina fosforečná je mísitelná s vodou ve všech poměrech a komerční síla je 30% H3PO2. Hypofosfity se používají v medicíně. Hypophosphorous kyselina je silné redukční činidlo, např. síran měďnatý formy extrahovaná hydridové Cu2H2, hnědá sraženina, která se vyvíjí vodík a listy mědi na oteplování; s dusičnanem stříbrným výnosy jemně rozptýlené stříbro; s sirné kyseliny výnosy síry a některé sirovodíku; s kyselinou sírovou výnosy sirné kyseliny, které reaguje jako výše; formy manganous ihned s draselného.
obecný popis
bezbarvá olejovitá kapalina nebo průsvitné krystaly s kyselým zápachem. Hustota 1,439 g / cm3. Teplota tání 26,5°C. vdechování par dráždí nebo spaluje dýchací cesty. Kapalina a páry mohou dráždit nebo spálit oči a kůži.
Vzduch & Reakce Vody
Deliquescentní. Rozpustný ve vodě.
reaktivita
kyselina fosforečná se při zahřátí rozkládá na kyselinu fosforečnou a spontánně hořlavý fosfin. Oxiduje se kyselinou sírovou s uvolňováním oxidu siřičitého a síry. Reaguje výbušně s oxidem rtuťnatým(II). Prudce reaguje s dusičnanem rtuťnatým(II). Neutralizuje báze při exotermních reakcích.
nebezpečí
nebezpečí požáru a výbuchu při kontaktu s oxidačními činidly.
zdravotní riziko
toxické; vdechnutí, požití nebo kontakt kůže s materiálem může způsobit vážné zranění nebo smrt. Kontakt s roztavenou látkou může způsobit vážné popáleniny kůže a očí. Zabraňte kontaktu s pokožkou. Účinky kontaktu nebo inhalace mohou být zpožděny. Oheň může vytvářet dráždivé, žíravé a / nebo toxické plyny. Odtok z řízení požáru nebo ředicí vody může být žíravý a / nebo toxický a může způsobit znečištění.
nebezpečí požáru
nehořlavá látka sama o sobě nehoří, ale může se při zahřátí rozkládat za vzniku korozivních a/nebo toxických výparů. Některé jsou oxidační činidla a mohou vznítit hořlavé látky (dřevo ,papír,olej, oblečení atd.). Při kontaktu s kovy se může vyvinout hořlavý plynný vodík. Kontejnery mohou při zahřátí explodovat.
metody čištění
kyselina fosforečná je běžným kontaminantem komerční 50% kyseliny hypofosforečné. Jenkins a Jones vyčistili tento materiál odpařením asi 600 ml v 1L baňce při 40o, za sníženého tlaku (v N2), Na objem asi 300 ml. Poté byl roztok ochladí, to byla převedena do širokohrdlé baňky, která byla zátkou a ponechána v Suchý led/aceton lázně na několik hodin zmrazit (pokud je to nutné, s poškrábání stěny). Když byla baňka poté ponechána při ca 5o po dobu 12hodin, asi 30-40% zkapalnilo a bylo znovu filtrováno. Tento proces se opakuje, pak solidní byl uložen přes Mg(ClO4)2 ve vakuu v exsikátoru v chladu. Následné crystallisations z n-butanol rozpuštěním při teplotě místnosti, a pak chlazení v ledové-solné lázně na -20o neprokázalo, očistit dále. Volná kyselina tvoří rozpustné krystaly m 26,5 o a je rozpustná v H2O a EtOH. Sůl NaH2PO2 může být čištěna pomocí aniontové výměnné pryskyřice