- Hypofosforihapon kemialliset ominaisuudet,käyttötarkoitukset,tuotanto
- ääriviivat
- kemialliset ominaisuudet
- käyttää
- myrkyllisyys
- vaarojen tunnistaminen
- valmistusmenetelmä
- tuotantomenetelmä
- kuvaus
- kuvaus
- kemialliset ominaisuudet
- fysikaaliset ominaisuudet
- käyttää
- määritelmä
- valmiste
- valmistusmenetelmät
- määritelmä
- reaktiot
- yleiskuvaus
- Ilma & Vesireaktiot
- Reaktiivisuusprofiili
- vaara
- terveysvaara
- palovaara
- puhdistusmenetelmät
Hypofosforihapon kemialliset ominaisuudet,käyttötarkoitukset,tuotanto
ääriviivat
Hypofosforihappo tunnetaan myös nimellä ”hypofosfiitti” se on väritön öljy tai delikesenssikide , se on tärkeä hieno kemiallinen tuote. Tärkein käyttö on pelkistävänä aineena sähköttömälle pinnoitukselle, fosforinen estää hartsin värjäytymisen, sitä voidaan käyttää myös esteröintireaktiokatalysaattorissa, kylmäaineessa, erityisesti erittäin puhtaan tuotteen natriumhypofosfiitin tuotantoon. Valmistusmenetelmiä on useita, yhteinen teollinen valmistusmenetelmä on ioninvaihtohartsimenetelmä ja elektrodialyysimenetelmä.
hypofosforihapon kemialliset ominaisuudet, käyttötarkoitukset, myrkyllisyys ja tuotantomenetelmät on toimittanut Andy of Chemicalbook. (2016-12-04)
kemialliset ominaisuudet
se on vetistyviä kiteitä tai väritöntä öljyä. Sulamispiste: 26,5℃. Suhteellinen tiheys (ominaispaino): 1,439 (kiinteä, 19℃). Se liukenee veteen, etanoliin ja eetteriin, ja sitä voidaan sekoittaa missä suhteessa tahansa veden, etanolin, asetonin kanssa. Ilmassa se herkästi hoikistuu siirappiseksi nesteeksi, ja vesiliuos on hapan.
Hypofosforihappo on monobaasihappo, vesiliuoksessa Hypofosforihappo on vahva happo, Ka = 10-2 (25℃); se on suhteellisen stabiili huoneenlämpötilassa; disproportioreaktio voi edetä 130℃: ssa, hajota fosfiiniksi ja fosforihapoksi:
2h3po2=H3PO4+PH3
sillä on voimakas pelkistyminen, raskasmetallisuolaliuos voidaan palauttaa metalleiksi, kuten Cu2 +, Hg2 +, Ag +, kuten:
4Ag+H3PO2+2H2)=4Ag+H3PO4+4h+
se on heikko hapetin, se voidaan pelkistää fosfiiniksi, fosfiiniksi kohdatessaan voimakkaan pelkistimen.
käyttää
1. Hypofosforihappoa käytetään pelkistimenä sähköttömässä pinnoituksessa;
2. Sitä voidaan käyttää estämään fosforihappohartsien värjäytymistä;
3. Sitä käytetään esteröintikatalyyttinä eli kylmäaineena;
4. Siitä valmistetaan hypofosfiittia, natriumsuoloja, mangaanisuoloja, rautasuoloja käytetään yleensä ravitsevina aineina;
5. Hypofosforihappoa käytetään lääketieteessä ja pelkistimenä, arseenin, telluurin määrityksessä sekä tantaalin, niobiumin ja muiden reagenssien erottamisessa.
6. Se on vahva pelkistävä aine, sitä voidaan käyttää natriumhypofosfiitin, kalsiumfosfaatin ja muiden hypofosfiitin valmistukseen.
7. Sitä voidaan käyttää pinnoitus kylpy. Lääkkeitä. pelkistysaine. yleiset reagenssit.
8. Se on vahva pelkistävä aine, sitä voidaan käyttää natriumhypofosfiitin, kalsiumfosfaatin ja muiden hypofosfiitin valmistuksessa.
9. Tätä tuotetta käytetään laajalti pelkistimenä, Ag, Cu, Ni, Hg ja muut metallit pelkistetään vastaavaan metalliin, AS: n, NB: n, Ta: n ja muiden reagenssien todentamiseksi, sitä voidaan käyttää NA: n, K: n, Ca: n, Mn: n, Fe: n ja muiden hypofosfiittityyppien valmistukseen.
myrkyllisyys
se on palamatonta. Mutta kun kosketukset reikä h agentti, se aiheuttaa tulipalon. Kun kohtaa hapettavan aineen, voi edetä väkivaltainen reaktio ja palaminen. Kuumennettaessa korkealle se voi hajota erittäin myrkylliseksi fosfiinikaasuksi tai jopa räjähtää. Se on syövyttävää. Hypofosforihappoa lisätään usein virvoitusjuomiin, ja koska se ei imeydy. Joten riski on pieni, mutta erityisen vahva hypofosfiitti satuttaa ruoansulatuskanavan. Vahingossa se roiskuu silmiin tai koskettaa ihoa, pesuun käytetään runsaasti vettä. Tuotannon toimijoiden olisi käytettävä suojavaatteita ja muita suojavaatteita. Tuotantolaitteet on tiivistettävä, työpaja on tuuletettava hyvin.
vaarojen tunnistaminen
vaaralauseke:
aiheuttaa vakavia ihon palovammoja ja silmävaurioita.
aiheuttaa vakavan silmävaurion
Turvalausekkeet:
älä hengitä pölyä/savua/kaasua/sumua/höyryjä / suihketta.
pese huolellisesti käsittelyn jälkeen.
Käytä suojakäsineitä ja silmien – / kasvonsuojainta.
nieltynä: suu huuhdellaan. Ei saa oksennuttaa.
jos on iholla (tai hiuksissa): kaikki saastuneet vaatteet on poistettava välittömästi. Huuhtele iho vedellä / suihkulla.
jos silmiin: huuhdellaan varovasti vedellä useiden minuuttien ajan. Poista piilolinssit, jos niissä on
ja ne on helppo tehdä. Jatka huuhtelua.
hengitettynä: siirrä uhri raittiiseen ilmaan ja pidä levossa asennossa, jossa on mukava hengittää.
soita välittömästi Myrkytystietokeskukseen tai lääkäriin.
Store locked up.
hävitä tämä aine ja sen säiliö vaarallisten tai erityisten jätteiden keräyspisteeseen.
valmistusmenetelmä
1. Fosfori-ja bariumhydroksidiliuosta kuumennetaan, bariumsuolaa Ba(H2PO2) 2 • 2H2O voi tuottaa, rikkihappoa lisätään hypofosforihappobariumliuokseen, Ba2+ voi saostua:
Ba (H2PO2)2+H2SO4=BaSO4+2h3po2
Hypofosforihappoa saadaan haihduttamalla alennetussa paineessa ja matalan lämpötilan kiteyttämällä. Tämän prosessin vuoksi bariumsuolan liukoisuus on pieni, joten saadun Hypofosforihapon pitoisuus ei ole korkea, teollisuustuote on puhdistettava uudelleenkiteyttämällä.
2. valkoisen fosforin bariumoksidi (tai kalkki) ja liuos kuumennetaan yhdessä sekundääriseksi bariumfosfaatiksi (tai kalsiumiksi) ja sitten se reagoi rikkihapon kanssa, se suodatetaan, konsentroidaan tuotteen saamiseksi tai natriumhypofosfiittiliuoksesta saadaan H-tyypin ioninvaihtohartsi voi johtaa tuotetta. Tämä menetelmä vaatii suuren määrän hartsia, ja hartsin uudistaminen ja pesuvaihe on hankala, se maksaa yleensä yli $ 7 per punta, se sopii vain pienen erän tuotantoon eikä sovellu laajamittaisiin teollisiin sovelluksiin.
3. Hypofosforihappoa valmistetaan elektrodialyysimenetelmällä, jossa elektrodialyysikenno jakautuu kolmeen osaan, ne ovat anodikammio, raaka-ainekammio ja katodikammio, Välituote erotetaan anionisella kalvolla ja kationisella kalvolla, kahden kalvon väliin asetetaan natriumhypofosfiittiliuos (pitoisuus 100g/l~500g/L), anodikammio on laimea hypofosforihapon liuos 5g/L, anodikammio on laimea natriumhydroksidiliuos ( 5g /L), napojen välissä DC (3V~36V) läpäisee, anodi vapauttaa happea ja tuottaa hypofosforihapon sekundäärituotteen; katodi emittoi vetyä ja tuottaa natriumhydroksidin sivutuotteena reaktioaika on 3~21 h. anodikammion ja katodikammion reaktiot ovat seuraavat:
anodikammio:
H2o==H++OH-
2oh-==O2+2H2O+4E
H++H2PO2-==H3PO2
katodikammio:
H2O==H++OH-
2h++2e==H2
na++Oh-==NaOH
elektrodialyysimenetelmä hypofosforihapon valmistusmenetelmä on yksinkertainen ja laiteinvestoinnit pieniä, se soveltuu massatuotantoon.
4. Alkaen teollisuuslaatuisesta natriumhypofosfiitista, Cl -, SO42-anioneista, jotka vaikuttavat hypofosforihapon laatuindikaattoreihin, poistetaan saostamalla, raskasmetalli-ionit poistetaan liuoksesta muodostamalla sulfidia ja käyttämällä sitten vahvaa happokationinvaihtohartsia natrium sekundäärifosfaatin saamiseksi, erittäin puhdasta tuotetta voidaan saada. Prosessi voi tuottaa korkealaatuista sekundaarista fosfaattia, teknisesti on mahdollista, prosessi on yksinkertainen, helppokäyttöinen, hyvä tuotteiden laatu, se voi vastata elektroniikkateollisuuden, puolustusteollisuuden ja muiden korkean teknologian alojen tarpeisiin.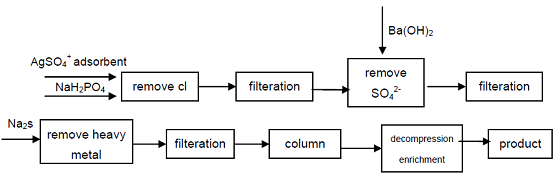
kuva 1 Hypofosforihapon tuotantoprosessi teollisesta Natriumhypofosfiitista.
5. Ioninvaihtohartsimenetelmä: noin 70 g vedellä kostutettua kationinvaihtohartsia pakataan lasiputkeen, jossa 5 mol/L kloorivetyhappoa kiertää noin 15min, kun se on perusteellisesti pesty vedellä, erittäin puhdas natriumhypofosfiitin vesiliuos (15 g/60 ml H2O) virtaa sen läpi, hartsikolonni pestään ensin 50 ml: lla, sitten 25 rnl tislatulla vedellä. Jätevedet happo ja pesu yhdistetään, se väkevöidään haihduttamalla vesihauteessa. Väkevä happo sijoitetaan suurtyhjiössä P205 kuivausrumpu nestehukka, jäähdytys ja kiteytys, suodatus, uudelleenkiteyttämällä, saada hypofosforihappotuote.
tuotantomenetelmä
Ioninvaihtohartsimenetelmä: noin 70 g vesiliukoisia kationinvaihtohartseja täytetään lasiputkeen. Kierrä 5 mol/L kloorivetyhappoa noin 15 minuuttia ja pese riittävästi vedellä. On korkea natriumhypofosfiittiliuos (15 g/60 ml H2O), joka virtaa hartsikolonnin läpi, minkä jälkeen se pestään ensin 50 ml: lla vettä ja huuhdellaan sitten 25 rnl tislatulla vedellä. Jätevedet ja pesuaineet yhdistettiin ja tiivistettiin haihduttamalla vesihauteeseen. Väkevä happo lähetetään erittäin tyhjiö, P205 kuivausrumpu nestehukka, jonka jälkeen jäähdytys kiteytys, suodatus ja uudelleenkiteyttämällä saada lopputuotteen hypofosforihapon.
kuvaus
Hypofosforihappo on voimakas pelkistävä agentti, jonka molekyylikaava on H3PO2. Epäorgaaniset kemistit viittaavat vapaaseen happoon tällä nimellä, vaikka sen Iupacnimi on dihydridohydroksidooksidofosforis eli fosfiinihapon hyväksyttävä nimi. Se on värittömästi sulava yhdiste,joka liukenee veteen, dioksaaniin ja alkoholeihin. Hypofosforisaksidin kaava kirjoitetaan yleensä H3PO2, mutta kuvaavampi esitys on HOP(O)H2, joka korostaa sen monoproottista luonnetta. Tästä haposta johdettuja suoloja kutsutaan fosfinaateiksi (hypofosfiiteiksi).
kuvaus
tämän hapon yleinen kaava on h4p2o6 ja se eroaa muista oksi-fosforihapoista. Se on monia peculiarities.It muodostuu fosforin ja fosforikaasujen ohella, kun fosfori hapettuu kosteassa ilmassa.Jos valkoinen fosfori altistuu ilmalle ja natriumasetaatti lisätään nesteeseen, joka muodostaa jonkin verran liukenematonta natriumhypofosfaattia, Na2H2P2O6 * 6h2oseparaatteja. Dinatriumhypofosfaattimonohydraatti on kuitenkin hyvin liukeneva ja hoikkeneva (98, 7 g/100 ml).
kemialliset ominaisuudet
väritön neste
fysikaaliset ominaisuudet
väritön kiteinen tai öljyinen neste; hapan haju; tiheys 1,493 g/cm3;sulaa 26,5°C: ssa; kiehuu 130°C: ssa; liukenee erittäin hyvin veteen, alkoholiin ja eetteriin; 50-prosenttisen vesiliuoksen den-sititeetti on 1,13 g / mL.
käyttää
Hypofosfiittien, galvanointiputkien valmistusta.
määritelmä
ChEBI: fosforioksohappo, joka koostuu yhdestä pentavalentista fosforista, joka on sitoutunut kovalenttisesti yksittäisten sidosten kautta kahteen vetyyn ja hydroksiryhmään sekä kaksoissidoksen kautta Happeen. Fosfiinihappoluokan lähtöaine.
valmiste
Hypofosforihappoa voidaan valmistaa eri menetelmillä:
1. Kiehuva valkoinen fosfori kalsiumhydroksidin kanssa:
P4 + 4Ca(OH)2 + 8H2O → 4CA(H2PO2)2 + 4h2
kalsiumsuola liukenee veteen. Rikkihapolla tehdyllä käsittelyllä saadaan hypofosforihappo:
(H2PO2)2CA + H2SO4 → 2H3PO2 + CaSO4
tuoteseos suodatetaan liukenemattoman CaSO4: n poistamiseksi. Hypofosforihapon vesiliukoisuus väkevöidään alennetussa paineessa.Kalsiumhydroksidin sijasta voidaan käyttää väkevää barytan vettä.2. Käsittelemällä natriumhypofosfiittia Nah2po2 ioninvaihtohartsilla.Natriumsuolaa voidaan valmistaa keittämällä valkoista fosforia natriumhydroksidiliuoksella edellä olevan 1 kohdan kaltaisella reaktiolla.
PH3 + 2i2 + 2H2O → H3PO2 + 4HI
edellä mainittua menetelmää voidaan pitää turvallisempana kuin whitefosporsin kuumentamista alkalilla.
Hypofosforihappoa on säilytettävä alle 50°C: ssa.sitä myydään kaupallisesti vesiliuoksena eri pitoisuuksina.
valmistusmenetelmät
Hypofosforihappoa muodostuu bariumhypofosfiitin ja rikkihapon reaktiolla ja suodattamalla bariumsulfaatti pois. Haihduttamalla liuos tyhjiössä 80 °C: ssa ja jäähdyttämällä sitten 0°C: een hypofosforihappo kiteytyy.
määritelmä
valkoinen kiteinen kiinteä aine. Se on monobaasihappo, joka muodostaa vedessä anionin H2PO2. Natriumsuolaa ja siten happoa voidaan valmistaa kuumentamalla keltaista fosforia natriumhydroksidiliuoksella. Vapaa happo ja sen suolat ovat voimakkaita pelkistäviä aineita.
reaktiot
Hypofosforihappo sekoittuu veteen kaikissa suhteissa ja sen kaupallinen vahvuus on 30% H3PO2. Hypofosfiittejä käytetään lääketieteessä. Hypofosforihappo on voimakas pelkistävä aine, esim. kuparisulfaatin kanssa muodostaa kuparihydridiä Cu2H2, ruskeaa saostumaa, joka kehittää vetykaasua ja jättää kuparin lämpenemiselle; hopeanitraatin kanssa tuottaa hienoksi jakautunutta hopeaa; rikkihapon kanssa tuottaa rikkihappoa ja jonkin verran rikkivetyä; rikkihapon kanssa tuottaa rikkihappoa, joka reagoi kuten edellä; muodostaa mangaanihappoa välittömästi permanganaatin kanssa.
yleiskuvaus
värittömät öljyiset nesteet tai vetistyvät kiteet, joilla on hapan haju. Tiheys 1,439 g / cm3. Sulamispiste 26,5°C. höyryjen hengittäminen ärsyttää tai polttaa hengitysteitä. Neste ja höyryt voivat ärsyttää tai polttaa silmiä ja ihoa.
Ilma & Vesireaktiot
Hoikistuvat. Vesiliukoinen.
Reaktiivisuusprofiili
HYPOFOSFORIHAPPO hajoaa kuumennettaessa fosforihapoksi ja spontaanisti syttyväksi fosfiiniksi. Hapetetaan rikkihapolla rikkidioksidin ja rikin vapautuessa. Reagoi räjähdysmäisesti elohopea (II) oksidin kanssa . Reagoi kiivaasti elohopea (II) nitraatin kanssa . Neutraloi emäkset eksotermisissä reaktioissa.
vaara
palo-ja räjähdysvaara kosketuksessa hapettavien aineiden kanssa.
terveysvaara
Myrkyllistä; hengitettynä, nieltynä tai ihokosketuksessa aineen kanssa voi aiheuttaa vakavan vamman tai kuoleman. Sulan aineen joutuminen kosketuksiin voi aiheuttaa vakavia palovammoja iholle ja silmiin. Vältä ihokosketusta. Kosketuksen tai hengittämisen vaikutukset voivat viivästyä. Tuli voi tuottaa ärsyttäviä, syövyttäviä ja/tai myrkyllisiä kaasuja. Palontorjunta-tai laimennusvedestä valuminen voi olla syövyttävää ja/tai myrkyllistä ja aiheuttaa pilaantumista.
palovaara
palamaton aine itsessään ei pala, mutta saattaa hajota kuumennettaessa tuottaakseen syövyttäviä ja/tai myrkyllisiä kaasuja. Jotkut ovat hapettimia ja saattavat sytyttää palavia aineita (puu, paperi, öljy, vaatteet jne.). Kosketuksesta metallien kanssa voi kehittyä syttyvää vetykaasua. Astiat saattavat räjähtää kuumennettaessa.
puhdistusmenetelmät
fosforihappo on yleinen kaupallisen 50-prosenttisen hypofosforihapon vierasaine. Jenkins ja Jones puhdistivat tämän aineen haihduttamalla noin 600 ml 1L: n pullossa 40o: ssa alennetussa paineessa (N2: ssa) noin 300 ml: n tilavuuteen. Kun liuos oli jäähdytetty, se siirrettiin suurisuiseen erlenmeyerkolviin, joka pysäytettiin ja jätettiin kuivajää/asetonikylpyyn useiksi tunneiksi jäätymään (tarvittaessa seinää raapimalla). Kun pullo sitten jätettiin ca 5o 12 tuntia, noin 30-40% siitä nesteytettiin, ja se suodatettiin uudelleen. Tämä prosessi toistettiin, minkä jälkeen kiinteä aine varastoitiin Mg: n(ClO4)2: n päälle vakuumieksikaattoriin kylmässä. Myöhemmät kiteytykset n-butanolista liuottamalla sitä huoneenlämmössä ja jäähdyttämällä sen jälkeen jääsuolahauteessa-20o: ssa eivät näyttäneet puhdistavan sitä enempää. Vapaa happo muodostaa deliktiivisiä kiteitä m 26,5 o ja liukenee H2O: hon ja EtOH: hon. NaH2PO2-suola voidaan puhdistaa anioninvaihtohartsilla