- Hipofoszforsav kémiai tulajdonságok,felhasználás, termelés
- vázlat
- kémiai tulajdonságok
- használ
- toxicitás
- VESZÉLYAZONOSÍTÁS
- előkészítési módszer
- gyártási módszer
- leírás
- leírás
- kémiai tulajdonságok
- fizikai tulajdonságok
- meghatározás
- készítmény
- termelési módszerek
- meghatározás
- reakciók
- Általános leírás
- Levegő & Víz Reakciók
- reaktivitási profil
- veszély
- egészségügyi veszély
- tűzveszély
- tisztítási módszerek
Hipofoszforsav kémiai tulajdonságok,felhasználás, termelés
vázlat
a Hipofoszforsav “hipofoszfit” néven is ismert , színtelen olaj vagy deliquescence kristály, fontos finom kémiai termék. A fő felhasználás redukálószerként szolgál az elektrolit nélküli bevonáshoz, a foszforsav megakadályozza a gyanták elszíneződését, felhasználható az észterezési reakció katalizátorában, a hűtőközegben is, különösen nagy tisztaságú termék nátrium-hipofoszfit előállításához. Számos előállítási módszer létezik, az előállítás általános ipari módszere az ioncserélő gyanta módszer és az elektrodialízis módszer.
a hipofoszforsav kémiai tulajdonságait, a felhasználásokat, a toxicitást és a gyártási módszereket andy a Chemicalbook szerkesztette. (2016-12-04)
kémiai tulajdonságok
deliquescent kristályok vagy színtelen olaj. Olvadáspont: 26,5 db. A relatív sűrűség (fajsúly): 1,439 (szilárd, 19++). Vízben, etanolban és éterben oldódik, és bármilyen arányban keverhető vízzel, etanollal, acetonnal. A levegőben könnyen szirupos folyadékká válik, a vizes oldat savas.
a Hipofoszforsav egybázisú sav, vizes oldatban a Hipofoszforsav erős sav, Ka = 10-2 (25 6db); szobahőmérsékleten viszonylag stabil; a diszproporcionációs reakció 130 6db-on folytatódhat, foszfin-és foszforsavvá bomlik:
2h3po2=H3PO4+PH3
erős redukcióval rendelkezik, a nehézfém-sóoldat visszaállítható olyan fémekre, mint a Cu2 +, Hg2 +, Ag +, mint például:
4Ag+H3PO2+2H2)=4AG+H3PO4+4H+
gyenge oxidálószer, foszfinra, foszfinra redukálható, ha erős redukálószerrel találkozik.
használ
1. A hipofoszforsavat redukálószerként használják elektrolit nélküli bevonáshoz;
2. Használható a foszforsavgyanta elszíneződésének megakadályozására;
3. Észterező katalizátorként, hűtőközegként használják;
4. Hipofoszfit, nátriumsók, mangánsók előállítására használják, a vassókat általában tápláló anyagként használják;
5. A hipofoszforsavat az orvostudományban és redukálószerként használják, az arzén, a tellúr és a tantál, a nióbium és más reagensek elválasztására.
6. Erős redukálószer, felhasználható nátrium-hipofoszfit, kalcium-foszfát és más hipofoszfit előállítására.
7. Ezt fel lehet használni a galvanizáló fürdő. Gyógyszerek. redukálószer. általános reagensek.
8. Erős redukálószer, felhasználható nátrium-hipofoszfit, kalcium-foszfát és más hipofoszfit előállítására.
9. Ezt a terméket széles körben használják redukálószerként, Ag, Cu, Ni, Hg és más fémek a megfelelő fémre redukálódnak, az As, Nb, Ta és egyéb reagensek ellenőrzésére, Na, K, Ca, Mn, Fe és más típusú hipofoszfit előállítására használható.
toxicitás
nem éghető. De amikor érintkezik a lyuk h szerrel, tüzet okoz. Amikor találkozik oxidálószerrel, heves reakció és égés folytatódhat. Ha magasra melegítik, erősen mérgező foszfingázra bomlik, vagy akár felrobbanhat. Maró hatású. A hipofoszforsavat gyakran hozzáadják az üdítőitalokhoz, mert nem szívódik fel. Tehát a kockázat kicsi,de különösen erős hipofoszfit fáj gasztrointesztinális. Véletlenül fröccsen a szemébe, vagy érintkezik a bőrrel, sok vizet használnak a mosáshoz. A gyártóknak védőruházatot és egyéb védőruházatot kell viselniük. A gyártóberendezéseket le kell zárni, a műhelyt jól szellőztetni kell.
VESZÉLYAZONOSÍTÁS
Figyelmeztető mondat:
súlyos bőrégést és szemkárosodást okoz.
Súlyos szemkárosodást okoz
Óvintézkedésre vonatkozó mondatok:
ne lélegezze be a port/füstöt/gázt/ködöt/gőzt/spray-t.
használat után alaposan meg kell mosni.
védőkesztyűt és szem – /arcvédőt kell viselni.
lenyelés esetén: a szájat ki kell öblíteni. Nem szabad hánytatni.
ha bőrre (vagy hajra) kerül: azonnal távolítsa el/vegye le az összes szennyezett ruhát. Öblítse le a bőrt vízzel / zuhanyzóval.
szembe kerülés esetén: óvatosan öblítse le vízzel néhány percig. Távolítsa el a kontaktlencséket, ha
jelen van és könnyen elvégezhető. Folytassa az öblítést.
belélegzés esetén: az áldozatot friss levegőre kell vinni, és nyugalomban kell tartani a légzéshez kényelmes helyzetben.
azonnal hívjon toxikológiai központot vagy orvost.
bolt zárva.
ezt az anyagot és tartályát veszélyes vagy különleges hulladékgyűjtő helyre kell ártalmatlanítani.
előkészítési módszer
1. Foszfor-és bárium-hidroxid-oldatot melegítjük, bárium-só Ba (H2PO2) 2 • 2H2O generálhat, kénsavat adunk hipofoszforsav bárium-oldathoz, Ba2+ kicsapódhat:
Ba(H2PO2)2+H2SO4=BaSO4+2h3po2
Hipofoszforsav csökkentett nyomáson és alacsony hőmérsékletű kristályosítással párologtatható. Ennek a folyamatnak köszönhetően a báriumsó oldhatósága kicsi, ezért a kapott Hipofoszforsav koncentrációja nem magas, az ipari terméket átkristályosítással kell tisztítani.
2. a bárium-oxid (vagy mész) és a fehér foszfor oldatát együtt melegítjük, hogy másodlagos bárium-foszfátot (vagy kalciumot) képezzünk, majd kénsavval reagálunk, szűrjük, koncentráljuk, hogy terméket kapjunk, vagy a nátrium-hipofoszfit oldat H-típusú ioncserélő gyanta származhat termék. Ez a módszer nagy mennyiségű gyantát igényel, és a gyanta regenerálása és mosási lépése nehézkes, általában több mint 7 dollárba kerül fontonként, csak kis tételes gyártásra alkalmas, és nem alkalmas nagyszabású ipari alkalmazásokhoz.
3. A hipofoszforsavat elektrodialízis módszerrel állítjuk elő, ahol az elektrodialízis sejt három részre oszlik, ezek anódkamra, nyersanyag-kamra és katódkamra, a köztiterméket anionos membrán és kationos membrán választja el egymástól, két membrán között nátrium-hipofoszfit-oldatot helyezünk el (100g/L~500g/L koncentráció), az anódkamra 5G/L Hipofoszforsav híg oldata, az anódkamra híg nátrium-hidroxid-oldat ( 5G /L), a pólusok között DC (3V~36V) van az anód oxigént bocsát ki, és a hipofoszforsav másodlagos termékét generálja; a katód hidrogént bocsát ki, és nátrium-hidroxid másodlagos termékét generálja, a reakcióidő 3~21h. az anódkamra és a katódkamra reakciói a következők:
anódkamra:
H2O==H++OH-
2OH-==O2+2H2O+4e
H++H2PO2-==h3po2
katódkamra:
H2O==H++OH-
2H++2e==H2
na++Oh – ==NaOH
elektrodialízis előállítási módszer a hipofoszforsav egyszerű, a berendezések beruházása kicsi, tömegtermelésre alkalmas.
4. Az ipari minőségű nátrium-hipofoszfitból kiindulva a Cl -, SO42-anionokat, amelyek befolyásolják a Hipofoszforsav minőségi mutatóit, kicsapással távolítják el, a nehézfémionokat szulfid képződésével távolítják el az oldatból, majd erős savas kationcserélő gyantát használnak nátrium-másodlagos foszfát előállításához, nagy tisztaságú termék kaphat. A folyamat kiváló minőségű másodlagos foszfátot képes előállítani, technikailag megvalósítható, a folyamat egyszerű, könnyű kezelhetőség, jó termékminőség, kielégítheti az elektronikai ipar, a védelmi ipar és más csúcstechnológiai területek igényeit.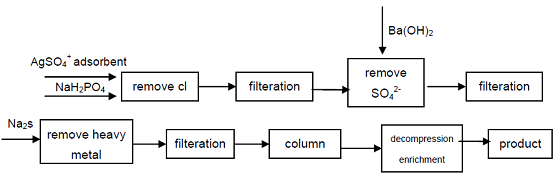
1.ábra Hipofoszforsav gyártási folyamata ipari nátrium-Hipofoszfitból.
5. Ioncserélő gyanta módszer: körülbelül 70 g vízzel megnedvesített kationcserélő gyantát üvegcsőbe csomagolnak 5 mol/L sósavval, amely körülbelül 15 perc körül kering, vízzel alaposan lemosva nagy tisztaságú vizes nátrium-hipofoszfit vizes oldat (15 g/60 ml H2O) áramlik rajta, a gyantaoszlopot először 50 ml-rel mossuk, majd 25 rnl desztillált vízzel. Az elfolyó savat és a mosást kombinálják, vízfürdőben történő bepárlással koncentrálják. A koncentrált savat nagy vákuumban helyezzük el a P205 szárítóval dehidratáció, hűtés és kristályosítás, szűrés, átkristályosítás, hipofoszforsav termék előállításához.
gyártási módszer
ioncserélő gyanta módszer:tegyen körülbelül 70 g vízoldható kationcserélő gyantát egy üvegcsőbe. Kering 5 mól / L sósavval körülbelül 15 percig, majd kellő mértékben mossa le vízzel. Magas vizes nátrium-hipofoszfit-oldatot (15 g/60 ml H2O) kell átfolytatni a gyantaoszlopon, majd először 50 ml vízzel mossuk, majd 25 rnl desztillált vízzel öblítsük le. Az elfolyó savat és a mosást vízfürdőn párologtatással egyesítettük és sűrítettük. A koncentrált savat az erősen vákuumos, P205 szárítóba küldjük kiszáradás céljából, majd hűtési kristályosítással, szűréssel és átkristályosítással kapjuk meg a hipofoszforsav késztermékét.
leírás
a Hipofoszforsav egy erős redukálószerh3po2 molekuláris képlettel. Szervetlen vegyészek hivatkoznak a szabad sav ezen a néven, bár Iupacneve dihidridohidroxidooxidofoszfor, vagy a foszfinsav elfogadható neve. Ez egy színtelenalacsony olvadáspontú vegyület,amely vízben, dioxánban, alkoholokban oldódik. A hipofoszforsav képlete általában H3PO2, de leíróbb Bemutatás a HOP (O)H2, amely kiemeli monoprotikus jellegét. Ebből a savból származó sókfoszfinátoknak (hipofoszfitoknak) nevezik.
leírás
ennek a savnak az általános képlete h4p2o6, és különbözik a többi oxifoszforsavtól. Sok van peculiarities.It foszforral és foszforral együtt keletkeziksavak, amikor a foszfort nedves levegő oxidálja.Ha a fehér foszfort levegőnek tesszük ki, és a folyadékhoz nátrium-acetátot adunk, ami a kissé oldhatatlan nátrium-hipofoszfát, Na2H2P2O6·6h2oszeparátumok. A nátrium-hipofoszfát-monohidrát azonban nagyon jól oldódik, és 98,7 g/100 ml-nél elfolyósodik.
kémiai tulajdonságok
színtelen folyadék
fizikai tulajdonságok
színtelen elfolyósodó kristályok vagy olajos folyadék; savanyú szag; sűrűség 1,493 g/cm3;olvad 26,5 kb-on; forr 130 Kb-on; nagyon oldódik vízben, alkoholban és éterben; az 50% – os vizes oldat sűrűsége 1,13 g / mL.
hipofoszfitok, galvanizáló fürdők készítését használja.
meghatározás
Chebi: foszfor-OXO-sav, amely egyetlen öt vegyértékű foszforból áll kovalens kötéssel két hidrogénhez és egy hidroxilcsoporthoz, valamint kettős kötéssel egy oxigénhez. A foszfinsavak osztályának szülője.
készítmény
a Hipofoszforsavat különböző módszerekkel állíthatjuk elő:
1. Fehér foszfor forrása kalcium-hidroxiddal:
P4 + 4CA(OH)2 + 8H2O 6ca (H2PO2)2 + 4H2
a kalciumsó vízben oldódik. A kénsavval végzett kezelés a hipofoszforsavat eredményezi:
(H2PO2)2CA + H2SO4 6H3PO2 + CaSO4
a termék elegyét leszűrjük az oldhatatlan CaSO4 eltávolítására. A hipofoszforsav vizes oldatát csökkentett nyomáson koncentráljuk.Kalcium-hidroxid helyett koncentrált baryta víz használható.2. Nátrium-hipofoszfit, nah kezelésével2po2ioncserélő gyantával.A nátriumsó előállítható fehér foszfor nátrium-hidroxid-oldattal történő forralásával, a fenti (1) – hez hasonló reakcióval.
PH3 + 2I2 + 2H2O ^ H3PO2 + 4HI
a fenti módszer biztonságosabbnak tekinthető, mint a fehérfoszfor lúgos melegítése.
a Hipofoszforsavat 50 6c alatt kell tárolni.
termelési módszerek
a Hipofoszforsavat bárium-hipofoszfit és kénsav reakciójával és bárium-szulfát szűrésével állítják elő. Az oldat vákuumban történő elpárologtatásával 80 6CC-on, majd 0ccc-re hűtve a hipofoszforsav kristályosodik.
meghatározás
fehér kristályos szilárd anyag. Ez egy egybázisú sav, amely a H aniont képezi2po2-vízben. A nátriumsót, tehát a savat úgy állíthatjuk elő, hogy a sárga foszfort nátrium-hidroxid-oldattal melegítjük. A szabad sav és sói erős redukálószerek.
reakciók
a Hipofoszforsav minden arányban elegyedik vízzel, kereskedelmi szilárdsága 30% H3PO2. A hipofoszfitokat az orvostudományban használják. A hipofoszforsav egy erős redukálószer, például réz-szulfáttal réz-hidrid cu2h2, barna csapadék képződik, amely hidrogéngázt alakít ki, és felmelegedéskor rézet hagy; ezüst-nitráttal finoman elosztott ezüst; kénsavval kén és néhány hidrogén-szulfid keletkezik; kénsavval kénsav keletkezik, amely a fentiek szerint reagál; mangánt képez azonnal permanganáttal.
Általános leírás
színtelen olajos folyadék vagy savanyú szagú delikvens kristályok. Sűrűség 1,439 g / cm3. Olvadáspont 26,5 6c. a gőzök belégzése irritálja vagy égeti a légutakat. A folyadék és a gőzök irritálhatják vagy megégethetik a szemet és a bőrt.
Levegő & Víz Reakciók
Elfolyó. Vízben oldódó.
reaktivitási profil
a HIPOFOSZFORSAV foszforsavvá és spontán gyúlékony foszfinná hevítve bomlik. Kénsavval oxidálódik kén-dioxid és kén felszabadulásával. Robbanásszerűen reagál a higany (II) – oxiddal . Hevesen reagál a higany (II) – nitráttal . Semlegesíti a bázisokat exoterm reakciókban.
veszély
tűz-és robbanásveszély oxidálószerekkel érintkezve.
egészségügyi veszély
mérgező; belélegzés, lenyelés vagy anyaggal való bőrrel való érintkezés súlyos sérülést vagy halált okozhat. Az olvadt anyaggal való érintkezés súlyos égési sérüléseket okozhat a bőrön és a szemen. Kerülje a bőrrel való érintkezést. Az érintkezés vagy a belélegzés hatásai késleltethetők. A tűz irritáló, maró és/vagy mérgező gázokat okozhat. A tűzvédelmi vagy hígítóvízből történő lefolyás maró hatású és / vagy mérgező lehet, és szennyezést okozhat.
tűzveszély
nem éghető, maga az anyag nem ég, de hevítés közben lebomolhat, hogy maró és/vagy mérgező füstöket képezzen. Néhány oxidálószer meggyújthatja az éghető anyagokat (fa, papír, olaj, ruházat stb.). Fémekkel érintkezve gyúlékony hidrogéngáz alakulhat ki. A tartályok hevítéskor felrobbanhatnak.
tisztítási módszerek
a foszforsav a kereskedelmi forgalomban kapható 50% – os hipofoszforsav gyakori szennyezője. Jenkins és Jones megtisztította ezt az anyagot úgy, hogy körülbelül 600 ml-t elpárologtatott egy 1 literes lombikban 40o-on, csökkentett nyomáson (N2-ben), körülbelül 300 ml térfogatra. Miután az oldatot lehűtöttük, egy széles szájú Erlenmeyer-lombikba helyeztük, amelyet lezártunk és néhány órán át szárazjég/aceton fürdőben hagytunk, hogy megfagyjon (ha szükséges, a fal megkarcolásával). Amikor a lombikot ca 5o-nál 12 órán át hagytuk, körülbelül 30-40% – a cseppfolyósodott, majd ismét leszűrtük. Ezt az eljárást megismételtük, majd a szilárd anyagot Mg(ClO4)2 felett tároltuk vákuum exszikkátorban hidegben. Az n-butanolból történő későbbi kristályosítások szobahőmérsékleten történő feloldásával, majd-20o-nál jég-sós fürdőben történő hűtéssel nem tűntek tovább megtisztítani. A szabad sav m 26,5 o delikvens kristályokat képez, és H2O-ban és EtOH-ban oldódik. A NaH2PO2 só anioncserélő gyantán keresztül tisztítható