次亜リン酸化学的性質、用途、生産
概要
次亜リン酸は別名”次亜リン酸”であり、無色の油または潮解結晶であり、重要な 主な用途は、無電解めっきのための還元剤として、リンは樹脂の変色を防止し、それはまた、エステル化反応触媒、冷媒、特に高純度製品次亜リン酸ナトリ 製造にはいくつかの方法があり、製造のための一般的な工業的方法はイオン交換樹脂法および電気透析法である。
次亜リン酸の化学的性質、用途、毒性、製造方法はChemicalbookのandyによって編集されています。 (2016-12-04)
化学的性質
潮解性の結晶または無色の油です。 融点:26.5℃。 比重(比重):1.439(固体、19℃)。 それは水、エタノールおよびエーテルに可溶であり、水、エタノール、アセトンと任意の割合で混合することができる。 空気中では、それはシロップ状の液体に容易に潮解し、水溶液は酸性である。
次亜リン酸はmonobasic酸、水溶液で、次亜リン酸です強い酸、Ka=10-2(25℃)です;それは室温で比較的安定しています;不均化の反作用は130℃でホスフィンおよびリン酸に分解します進むことができます:
2H3PO2=H3PO4+PH3
それにCu2+、Hg2+のような金属に強い減少が、重金属の塩解決元通りにすることができますあります、ag+、のような:
4ag+H3PO2+2H2)=4ag+H3PO4+4H+
それはホスフィン、ホスフィンに弱い酸化剤、それ減らすことができますとき強い還元剤に遭遇します。
は
1を使用します。 次亜リン酸は、無電解めっきの還元剤として使用されています。
2. リン酸樹脂の変色を防止するために使用できます。
3. それはエステル化の触媒、冷却剤として使用されます;
4。 それは次亜リン酸塩、ナトリウム塩、マンガン塩、鉄塩を生成するために使用され、一般的に栄養物質として使用されます。
5。 次亜リン酸は、医薬品および還元剤、ヒ素の定量、テルルおよびタンタル、ニオブおよび他の試薬の分離として使用される。
6. それは次亜リン酸ナトリウム、リン酸カルシウムおよび他の次亜リン酸ナトリウムの準備に強い還元剤、それ使用することができますです。
7. それはめっきの浴室に使用することができます。 医薬品… 還元剤。 一般的な試薬。
8. それは次亜リン酸ナトリウム、リン酸カルシウムおよび他の次亜リン酸ナトリウムの作成で強い還元剤、それ使用することができますです。
9. この製品は、還元剤、Ag、Cu、Ni、Hgおよび他の金属が対応する金属に還元され、As、Nb、Taおよび他の試薬の検証のために広く使用されており、na、K、Ca、Mn、Feおよび他の
毒性
不燃性です。 しかし穴Hの代理店、それが付いている接触により火を引き起こす時。 酸化代理店に会うとき、激しい反作用および燃焼は進むことができます。 それが最高に熱されるとき、非常に有毒なホスフィンのガスに分解できましたりまた更に爆発します。 それは腐食性です。 次亜リン酸は、多くの場合、清涼飲料に添加され、それが吸収されないためです。 だから、リスクは小さいですが、特に強い次亜リン酸は胃腸を傷つけます。 偶然それは目にはねかけるか、または皮に、沢山の水洗浄されるのに使用されています連絡します。 生産事業者は、防護服およびその他の防護服を着用する必要があります。 生産設備は研修会よく換気されるべきです密封されるべきです。
ハザード識別
ハザードステートメント:
は、重度の皮膚やけどや眼の損傷を引き起こします。
深刻な眼の損傷を引き起こす
予防的声明:
塵/発煙/ガス/霧/蒸気/スプレーを呼吸しないで下さい。
取り扱い後は十分に洗浄してください。
保護手袋と目/顔の保護を着用してください。
飲み込んだ場合:口をすすいでください。 嘔吐を誘発しないでください。
皮膚(または髪)に付着した場合:汚染された衣類をすべて直ちに取り外し/脱ぐ。 水/シャワーが付いている洗浄の皮。
目に入った場合:水で数分間慎重にすすいでください。 コンタクトレンズを外し、
があれば、簡単に行うことができます。 すすぎを続けます。
吸入した場合:犠牲者を新鮮な空気にさらし、呼吸に適した位置に安静に保つ。
すぐに毒物センターまたは医師/医師に連絡してください。
この物質およびその容器は、危険または特別な廃棄物収集ポイントに廃棄してください。
調製方法
1. リンと水酸化バリウム溶液が加熱され、バリウム塩Ba(H2PO2)2•2h2Oが生成することができ、硫酸は次亜リン酸バリウム溶液に添加され、Ba2+が沈殿することができる:
Ba(H2PO2)2+H2SO4=Baso4+2h3PO2
次亜リン酸は減圧下および低温結晶化下で蒸発することによって得ることができる。 このプロセスのために、バリウム塩の溶解度は小さいので、得られた次亜リン酸の濃度は高くなく、工業製品は再結晶によって精製されるべきである。
2. 酸化バリウム(または石灰)と白リンの溶液を一緒に加熱して二次リン酸バリウム(またはカルシウム)を形成し、硫酸と反応させ、濾過し、濃縮して生成物、または次亜リン酸ナトリウム溶液を得るH型イオン交換樹脂が生成物を得ることができる。 この方法は、大量の樹脂を必要とし、樹脂の再生と洗浄工程は面倒であり、それは一般的にポンド当たり$7以上の費用がかかり、それは小バッチ生産に
3. 次亜リン酸は電気透析法によって調製され、前記電気透析セルは三つの部分に分割され、それらは陽極室、原料室および陰極室であり、中間体は陰イオン膜および陽イオン膜によって分離され、二つの膜の間に次亜リン酸ナトリウム溶液が置かれる(濃度は100g/L-500g/L)、陽極室は次亜リン酸5g/Lの希薄溶液であり、陽極室は希薄水酸化ナトリウム溶液(5g/L)であり、極間DC(3V-36V)が渡され、陽極放出される。酸素、および次亜リン酸の二次生成物を発生させます; 陽極室と陰極室の反応は次のとおりです:
陽極室:
H2O==H++OH-
2OH-==O2+2H2O+4e
H++H2PO2-==H3PO2
陰極室:
H2O==H++OH-
2OH-==O2+2H2O+4e
h++H2PO2-==H3PO2
陰極室:
H2O==H++OH-
2OH-==O2+2h2O+4e
h++h2PO2-==h3PO2
陰極室:
h2O==H++OH-
h2O==H++OH-
2h++2e==h2
na++Oh-==naoh
電気透析調製法次亜リン酸は簡単であり、設備投資は小さいです、それは大量生産のために適しています。
4. 産業等級の次亜リン酸ナトリウムから始まって、Cl、次亜リン酸の質の表示器に影響を与えるSO42陰イオンは沈殿物によって取除かれます、重金属イ プロセスは技術的に実行可能です、プロセスです簡単で、容易な操作、よい製品品質、それ電子産業、防衛産業および他のハイテクな分野の必要性を満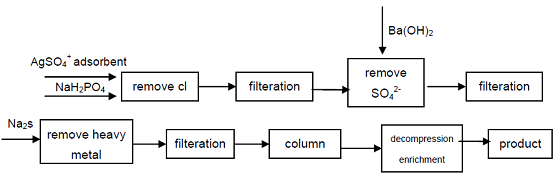
図1工業用次亜リン酸ナトリウムからの次亜リン酸の製造プロセス。
5. イオン交換の樹脂方法:水とぬらされる陽イオン交換の樹脂の約70gは15minについて循環する5mol/L塩酸が付いているガラス管に水と完全に洗浄された後、高い純度の水様の次亜リン酸ナトリウムの水溶液(15g/60ml H2O)それを通って流れます、樹脂のコラムは50のmlと最初に、そして25rnlの蒸留水と洗浄されます。 排水された酸と洗浄が組み合わされ、水浴中で蒸発することにより濃縮される。 濃縮された酸は、脱水、冷却および結晶化、濾過、再結晶のためにP205乾燥機を用いて高真空中に置かれ、次亜リン酸生成物を得る。
製造方法
イオン交換樹脂方法:水溶性陽イオン交換樹脂を約70g入れてガラス管に充填する。 5mol/L塩酸で約15分間循環させ、水で十分に洗浄する。 高次亜リン酸ナトリウム水溶液(15g/60ml H2O)を樹脂カラムに流し、最初に50mlの水で洗浄した後、25rnl蒸留水ですすいでください。 流出した酸および洗浄液を合わせ、水浴上で蒸発させることによって濃縮した。 濃縮された酸は、脱水のために高真空、p205乾燥機に送られ、続いて冷却結晶化、濾過および再結晶化が行われ、次亜リン酸の完成品が得られる。
説明
次亜リン酸は、H3PO2の分子式を持つ強力な還元剤です。 無機chemistsreferこの名前によって自由な酸へのIUPACnameがdihydridohydroxidooxidophosphorus、またはホスフィン酸のtheacceptable名前であるが。 それは水、ジオキサンおよびアルコールで溶けるcolorlesslow溶ける混合物です。 Hypophosphorousacidのための方式は一般にh3PO2書かれているが、より説明的な提示はhop(O)h2であるhighlightsitsのmonoprotic特性。 この酸に由来する塩はリン酸塩(次亜リン酸塩)と呼ばれる。
説明
この酸は、一般式ofh4p2o6を有し、他のオキシ-リン酸とは異なる。 それは多くを持っていますpeculiarities.It リンおよびリン酸と一緒に形成される酸、リンが湿った空気によって酸化されるとき。白リンが空気にさらされ、アセテートナトリウムが液体に添加されると、やや不溶の次リン酸ナトリウム、Na2h2P2O6·6h2oseparatesが形成される。 しかし、次亜リン酸ナトリウム一水和物は、〜98.7g/100mlで非常に溶解性で潮解性である。
化学特性
無色の液体
物理的性質
無色のdeliquescent水晶か油性液体;酸っぱい臭気;密度1.493g/cm3;26.5°cで溶けます;130°Cで沸騰;水、アルコールおよびエーテルで非常に溶けます;50%の水溶液のden-sityは1.13g/mLです。
は、次亜リン酸塩、電気めっき浴の調製を使用しています。
定義
ChEBI:二つの水素とヒドロキシ基に単結合を介して共有結合し、酸素に二重結合を介して結合した単一の五価リンのオキソ酸で構成されています。 ホスフィン酸のクラスの親。
調製
次亜リン酸は、様々な方法により調製することができる:
1. 水酸化カルシウムで白リンを沸騰させる:
P4+4ca(OH)2+8H2O→4ca(H2PO2)2+4H2
カルシウム塩は水に可溶である。 硫酸で処理すると、次亜リン酸が得られます:
(H2PO2)2Ca+H2SO4→2H3PO2+Caso4
生成物混合物を濾過して不溶性のCaso4を除去する。 次亜リン酸の水溶液は減圧下で濃縮される。水酸化カルシウムの代わりに濃縮されたバリタ水を使用することができる。2. 次亜リン酸ナトリウムを処理することにより、nah2Po2はイオン交換樹脂を有する。ナトリウム塩は、白リンを水酸化ナトリウムの溶液で沸騰させることにより、上記(1)と同様の反応によって製造することができる。
PH3+2I2+2H2O→H3PO2+4HI
上記の方法は、白リンをアルカリで加熱する方法よりも安全であると考えることができる。
次亜リン酸は50℃以下で保存する必要があります。
製造方法
次亜リン酸は、次亜リン酸バリウムと硫酸を反応させ、硫酸バリウムを濾過することによって形成される。 溶液を真空中で80℃で蒸発させ、0℃に冷却することにより、次亜リン酸が結晶化する。 <5640>定義<8868>白色の結晶性固体である。 それは水の陰イオンH2PO2–を形作るmonobasic酸です。 ナトリウム塩、したがって酸は、黄リンを水酸化ナトリウム溶液で加熱することによって調製することができる。 遊離酸およびその塩は強力な還元剤である。
反応
次亜リン酸はすべての割合で水と混和性であり、商業的強度は30%H3PO2である。 次亜リン酸は医学で使用されています。 次亜リン酸は強力な還元剤であり、例えば硫酸銅は水素化第一銅Cu2H2を形成し、水素ガスを発生させ、加温時に銅を残す茶色の沈殿物、硝酸銀では細かく分割された銀を生成し、亜硫酸では硫黄と硫化水素を生成し、硫酸では上記のように反応する亜硫酸を生成し、過マンガン酸塩ですぐにマンガンを生成する。
一般的な説明
酸っぱい臭いを持つ無色の油性液体または潮解性の結晶。 密度1.439g/cm3。 融点26.5℃蒸気の吸入は、気道を刺激または燃焼させる。 液体および蒸気は目および皮を苛立たせるか、または燃やすかもしれません。
空気&水
潮解性。 水溶性。
反応性プロファイル
次亜リン酸は、加熱するとリン酸と自発的に可燃性のホスフィンに分解する。 二酸化硫黄および硫黄の解放が付いている硫酸によって酸化されます。 酸化水銀(II)と爆発的に反応する。 硝酸水銀(II)と激しく反応する。 発熱反応で塩基を中和する。
危険性
酸化剤と接触する火災および爆発の危険性。
健康被害
毒性;吸入、摂取、または物質との皮膚接触は、重度の傷害または死亡の原因となる可能性があります。 溶融した物質と接触すると、皮膚や目に重度の火傷を引き起こす可能性があります。 皮膚の接触を避けて下さい。 接触または吸入の影響は遅れることがあります。 火災は、刺激性、腐食性および/または有毒ガスを生成する可能性があります。 火災制御または希釈水からの流出は、腐食性および/または毒性があり、汚染を引き起こす可能性があります。
火災の危険性
不燃性で、物質自体は燃焼しませんが、加熱時に分解して腐食性および/または有毒な煙霧を生成する可能性があります。 いくつかは酸化剤であり、可燃物(木材、紙、油、衣類など)を発火させる可能性があります。). 金属との接触は可燃性の水素ガスを発生させる可能性があります。 容器は熱されたとき爆発するかもしれません。
精製方法
リン酸は、市販の50%次亜リン酸の一般的な汚染物質です。 JenkinsおよびJonesは、減圧下(N2中)で4 0℃で1Lフラスコ中で約6 0 0mlを蒸発させて約3 0 0mlの体積にすることによって、この物質を精製した。 溶液を冷却した後、それを広口のErlenmeyerフラスコに移し、これを停止させ、ドライアイス/アセトン浴中に数時間放置して凍結させた(必要であれば、壁を掻き 次いで、フラスコをca5oに1 2時間放置すると、その約3 0〜4 0%が液化し、再び濾過された。 このプロセスを繰り返し、次いで、固体をmg(Clo4)2上で低温の真空乾燥器中に貯蔵した。 室温でそれを溶解し、-20oで氷塩浴中で冷却することにより、n-ブタノールからのその後の結晶化は、それをさらに浄化するようには見えませんでした。 遊離酸は潮解性結晶m26.5oを形成し、H2OおよびEtOHに可溶性である。 Nah2Po2塩は陰イオン交換樹脂を通して浄化することができます