 |
 |
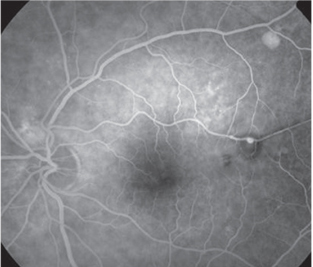
| 4. Fluorescein-Angiographie zur Darstellung eines retinalen arteriellen Makroaneurysmas (RAM), resultierend aus Hypertonie. Unkontrollierter Blutdruck kann das Schlaganfallrisiko um das Vier- bis Sechsfache erhöhen. |
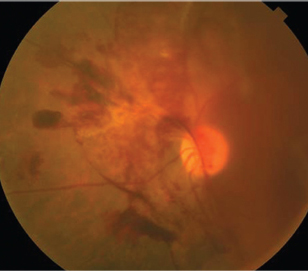
5. In der Wisconsin Epidemiological Study bei Diabetischer Retinopathie wurde festgestellt, dass das Schlaganfallrisiko bei Patienten mit proliferativer diabetischer Retinopathie sechsmal höher war.26 |
Hypertonie
Erhöhter Blutdruck kann das Schlaganfallrisiko durch Arteriosklerose der Gefäße im Laufe der Zeit erhöhen; Dies kann zu Verstopfung kleiner Gefäße im Gehirn und Ischämie führen.
Hypertonie kann auch Blutgefäße schwächen und ein Aneurysma verursachen, das den Blutfluss stören kann. Im Auge wurde gezeigt, dass frühe mikrovaskuläre Veränderungen durch Bluthochdruck, wie Arteriolenverengung, Arterienvenenstich und Arterientrübung, das Schlaganfallrisiko erhöhen. In der Studie Atherosclerosis Risk in Communities (ARIC) wurde gezeigt, dass Arterienvenenstich und Arterienverengung die Wahrscheinlichkeit eines MRT-definierten subklinischen Infarkts um fast das Doppelte erhöhen.17
Mit zunehmendem Schweregrad der Hypertonie kann es zu einem weiteren Abbau der Blut-Netzhaut-Schranke und zu „moderaten“ Befunden wie flammenförmigen Blutungen, Watteflecken und Exsudaten kommen. In ähnlicher Weise wurde gezeigt, dass Watteflecken und Blutungen das relative Risiko eines Schlaganfalls um das Zwei- bis Dreifache erhöhen im Vergleich zu Personen ohne diese Netzhautbefunde.18
Eine“schwere“ hypertensive Retinopathie kann auftreten, wenn ein erhöhter Blutdruck einen Anstieg des Hirndrucks und eine Schwellung des Sehnervs verursacht. Schwere Hypertonie kann auch zum Infarkt von Segmenten der Choriocapillaris führen. Siegrist-Streifen beziehen sich auf lineare RPE-Hyperplasie über infraktierten Aderhautarteriolen, und Elschnig-Flecken sind ein Zeichen für nicht perfundierte Choriokapillaren. Unkontrollierte Hypertonie erhöht nachweislich das Schlaganfallrisiko um das Vier- bis Sechsfache, daher ist dies eine weitere Gruppe, die wir aufklären müssen (Abbildung 4).
Hypertonie kann auch zu retinal-arteriellen Makroaneurysmen führen. Erhöhter Blutdruck kann dazu führen, dass die Arterien der glatten Muskulatur durch Kollagen ersetzt werden, wodurch die Arterienwand weniger elastisch und anfälliger für die Bildung von Aneurysmen wird. Dies tritt typischerweise bei älteren weiblichen Patienten auf und ist in bis zu 79% der Fälle mit Bluthochdruck verbunden.19
Diabetes
Diabetes erhöht das Schlaganfallrisiko, indem es den Blutfluss hemmt und die Ischämie fördert. Im Auge wird eine diabetische Retinopathie häufig bei Personen festgestellt, die den Blutzucker schlecht kontrolliert haben oder die Krankheit länger als 10 Jahre hatten. Die ARIC-Studie ergab, dass das Risiko eines ischämischen Schlaganfalls bei Personen mit nicht proliferativer diabetischer Retinopathie zwei- bis dreimal höher war als bei Personen ohne diabetische Retinopathie.17 Darüber hinaus schien das Ausmaß der diabetischen Retinopathie auch mit dem Schlaganfallrisiko zu korrelieren. Von den 1.305 Personen in der Studie, die keine diabetische Retinopathie hatten, erlitten nur 3,9% einen ischämischen Schlaganfall. Im Gegensatz dazu 9.6% der Personen mit leichter bis mittelschwerer diabetischer Retinopathie und 11,4% der Personen mit schwerer diabetischer Retinopathie erlitten einen Schlaganfall.20
Diabetiker mit proliferativer diabetischer Retinopathie (PDR) haben nicht nur ein Risiko für verheerende Augenfolgen, wenn sie nicht richtig behandelt werden, sondern auch ein erhöhtes Schlaganfallrisiko. Die epidemiologische Studie in Wisconsin zur diabetischen Retinopathie ergab, dass das Schlaganfallrisiko bei Patienten mit PDR sechsmal höher war und das Risiko einer Schlaganfallmortalität im Vergleich zu Patienten ohne PDR doppelt so hoch war (Abbildung 5).21,22
Asymmetrische diabetische Retinopathie tritt bei etwa 5% bis 10% der Diabetiker auf und kann auch ein Zeichen für eine Halsschlagader und ein erhöhtes Schlaganfallrisiko sein.23,24 In früheren Studien wurde „Asymmetrie“ als PDR auf einem Auge ohne Retinopathie auf dem anderen Auge oder als zwei- bis dreigradiger Unterschied zwischen den Augen definiert. Die Literatur war etwas inkonsistent. In der bahnbrechenden Studie zu diesem Thema fanden Andrew Gay, MD, und Arthur Rosenbaum, MD, heraus, dass bei der Mehrheit ihrer Probanden eine schwere Karotisstenose ipsilateral zum Auge mit weniger Retinopathie gefunden wurde.25 Sie theoretisierten, dass die Karotiserkrankung das Fortschreiten der Retinopathie im ipsilateralen Auge verzögert oder im kontralateralen Auge beschleunigt.25
Seitdem haben zwei bedeutende Studien ergeben, dass die Verbindung nicht so endgültig ist. Die Duker-Gruppe fand heraus, dass es „50/50“ war, ob das ipsilaterale oder kontralaterale Auge mit PDR eine schwerere Karotisstenose aufwies.23 Sie argumentierten, dass die in der Gay-Studie verwendete Technik, die Ophthalmodynamometrie, kein direkter Beweis für eine Karotisstenose sei.23 Ihre Ergebnisse wurden durch eine andere Studie aus Japan gestützt, in der vorgeschlagen wurde, dass das ischämische Augensyndrom additiv zur diabetischen Retinopathie sein kann und dass PDR bei asymmetrischer Retinopathie eher auf der gleichen Seite wie die Karotisstenose liegt.26
 Fall-zu-Fall-Basis
Fall-zu-Fall-Basis
Während okuläre Manifestationen von Erkrankungen der Halsschlagader (TMVL, VSR, OIS, Netzhautembolien) einen klaren Zusammenhang mit einem erhöhten zukünftigen Schlaganfallrisiko haben und in fast allen Fällen eine Patientenaufklärung rechtfertigen, ist die Notwendigkeit, Patienten mit mikrovaskulären Symptomen (diabetische und hypertensive Retinopathie) aufzuklären, für einige Praktiker möglicherweise nicht so klar.
Während Arterie-Vene-Nicking und milde nicht-proliferative diabetische Retinopathie gezeigt wurden, um das Risiko für zukünftige Schlaganfall in bestimmten Studien zu erhöhen, wenn der Blutdruck und / oder Blutzucker sind gut kontrolliert, einige ODs fühlen sich möglicherweise nicht gezwungen, ihren Patienten über Schlaganfall aufzuklären. Stattdessen können sie sich dafür entscheiden, den Patienten über Blutzucker- und / oder Blutdruckkontrolle aufzuklären, was wahrscheinlich für Patienten mit geringem Risiko ausreichend ist.
Letztendlich sollte die Notwendigkeit, unsere Patienten über das Schlaganfallrisiko und die Anzeichen eines Schlaganfalls aufzuklären, von Patient zu Patient erfolgen und hängt von der Persönlichkeit des Patienten sowie dem Komfort des Arztes ab. Ältere Patienten mit multiplen Vaskulopathien, die ihre Medikamente nicht einhalten, sind wahrscheinlich bessere Kandidaten für eine Ausbildung im Vergleich zu relativ jüngeren und gesünderen Personen, die ihre Behandlungen besser einhalten.
Insgesamt kann die Rolle des Augenoptikers bei der Erkennung des aktuellen Schlaganfalls und der Verhinderung zukünftiger Vorfälle von größter Bedeutung sein. Da die Mehrheit der Risikopatienten schlecht über die Anzeichen eines Schlaganfalls und die Notwendigkeit einer dringenden Versorgung informiert ist, können wir unseren Patienten helfen, diese Anzeichen zu erkennen und angemessen zu handeln.
Dr. Chu praktiziert im Salisbury VA Medical Center in Salisbury, NC.
1. Rosamond W, Flegal K, Furie K, et al. Herzkrankheit und Schlaganfall Statistiken-2008 Update: ein Bericht des American Heart Association Statistics Committee und Schlaganfall Statistik Unterausschuss. Durchblutung. 29. Januar 2008;117(4): e25-2146.
2. In: Mosley I, Nicol M, Donnan G, et al. Schlaganfall-Symptome und die Entscheidung, einen Krankenwagen zu rufen. Schlaganfall. 2007 Februar;38(2):361-6.
3. Mikulík R, Bunt L, Hrdlicka D, et al. Aufruf von 911 als Reaktion auf Schlaganfall: eine landesweite Studie zur Beurteilung des definitiven individuellen Verhaltens. Schlaganfall. 2008 Juni;39(6):1844-9.
4. Bull DA, Fante RG, Jäger GC, et al. Korrelation ophthalmischer Befunde mit Karotisstenose. In: J Cardiovasc Surg (Torino). 1992 Juli-August;33(4): 401-6.
5. In: Lawrence PF, Oderich GS. Ophthalmologische Befunde als Prädiktoren für Erkrankungen der Halsschlagader. Vasc Endovaskuläre Chirurgie 2002 Nov-Dez;36 (6): 415-24.
6. McCullough HK, Reinert CG, Hynan LS, et al. Augenbefunde als Prädiktoren für eine Verschlusskrankheit der Halsschlagader: Ist die Karotis-Bildgebung gerechtfertigt? J Vasc Surg. 2004 August;40(2):279-86.
7. Klijn C, Kappelle LJ, van Schooneveld MJ, et al. Venöse Stase-Retinopathie bei symptomatischem Verschluss der Halsschlagader: Prävalenz, Ursache und Ergebnis. Schlaganfall. 2002 Beschädigen;33(3): 695-701.
8. Sivalingam A, Brown GC, Magargal LE, Menduke H. Das okuläre ischämische Syndrom. II. Mortalität und systemische Morbidität. In: Int Ophthalmol. 1989 Mai;13(3):187-91.
9. Atebara N, Braun GC. Kapitel 12: Okuläres ischämisches Syndrom. In: Duanes klinische Augenheilkunde . Band 3. Philadelphia: Lippincott Williams und Wilkins Publishers; 2006.
10. Braun GC, Magargal LE. Das okuläre ischämische Syndrom. Klinische, fluoreszenzangiographische und karotisangiographische Merkmale. In: Int Ophthalmol. 1988 Februar;11(4): 239-51.
11. Hayreh SS, Podhajsky P, Zimmerman MB. Netzhautarterienverschluss: assoziierte systemische und ophthalmische Anomalien. Augenheilkunde. 2009 Oktober;116(10):1928-36.
12. Klein R, Klein BE, Jensen SC, et al. Netzhautembolien und Schlaganfall: die Beaver Dam Eye Study. Arch Ophthalmol. 1999 August; 117(8): 1063-8.
13. Arruga J, Sanders MD. Ophthalmologische Befunde bei 70 Patienten mit Anzeichen einer Netzhautembolie. Augenheilkunde.1982 Dezember; 89(12): 1336-47.
14. Hollenhorst RW. Gefäßstatus von Patienten mit Cholesterinembolien in der Netzhaut. In: Am J Ophthalmol. 1966 Mai;61(5 Pt 2): 1159-65.
15. Wang JJ, Cugati S, Knudtson MD, et al. Retinale Arteriolenembolien und Langzeitmortalität: Gepoolte Datenanalyse von zwei älteren Populationen. Schlaganfall. 2006 Juli;37(7):1833-6.
16. Chang YS, Jan RL, Weng SF, et al. Netzhautarterienverschluss und das 3-Jahres-Schlaganfallrisiko in Taiwan: eine landesweite Bevölkerungsstudie. In: Am J Ophthalmol. 2012 Oktober;154(4):645-52.
17. Cooper LS, Wong TY, Klein R, et al. Retinale mikrovaskuläre Anomalien und MRT-definierter subklinischer Hirninfarkt: Das Atherosklerose-Risiko in dieser Studie. Schlaganfall. 2006 Januar;37(1):82-6.
18. Wong TY, Klein R, Couper DJ, et al. Retinale mikrovaskuläre Anomalien und Schlaganfall: das Atherosklerose-Risiko in der Studie. Lancet. 2001 Oktober 6;358(9288):1134-40.
19. Panton RW, Goldberg MF, Farber MD. Retinale arterielle Makroaneurysmen: Risikofaktoren und Naturgeschichte. In: Br J Ophthalmol. 1990 Oktober;74(10): 595-600.
20. In: Cheung N, Rogers S, Couper DJ, et al. Ist die diabetische Retinopathie ein unabhängiger Risikofaktor für einen ischämischen Schlaganfall? Schlaganfall. 2007 Februar;38(2): 398-401.
21. Klein R, Klein SEIN, Moss SE. Epidemiologie der proliferativen diabetischen Retinopathie. Diabetes-Versorgung. 1992 Dezember;15(12):1875-91.
22. Klein R, Klein sein, Moss SE, Cruickshanks KJ. Assoziation von Augenerkrankungen und Mortalität bei Diabetikern. Arch Ophthalmol. 1999 November;117(11):1487-95.
23. Duker JS, Brown CG, Bosley TM, et al. Asymmetrische proliferative diabetische Retinopathie und Karotiserkrankung. Augenheilkunde. 1990 Juli;97(7): 869-74.
24. Valone JA Jr, McMeel JW, Franks EP. Einseitige proliferative diabetische Retinopathie. II. Klinischer Verlauf. Arch Ophthalmol.1981 August;99(8): 1357-61.
25. Homosexuell AJ, Rosenbaum AL. Retinaler Arteriendruck bei asymmetrischer diabetischer Retinopathie. Arch Ophthalmol. 1966 Juni;75(6): 758-62.
26. Dogru M, Inoue M, Nakamura M, Yamamoto M. Modifizierende Faktoren im Zusammenhang mit asymmetrischer diabetischer Retinopathie. Auge (Lond). 1998;12(Pt 6):929-33.
27. Weitere Informationen zu: Dennis M., Bamford J., Sandercock P., Warlow C. Prognose der transitorischen ischämischen Attacke im Oxfordshire Community Stroke Project. Schlaganfall. Juni 1990;21(6): 848-53.
28. Rothwell PM, Giles MF, Chandratheva A, et al. Wirkung der dringenden Behandlung von transitorischer ischämischer Attacke und kleinem Schlaganfall auf den frühen rezidivierenden Schlaganfall (EXPRESS-Studie): ein prospektiver populationsbasierter sequentieller Vergleich. Lancet. 2007 Oktober 20;370(9596):1432-42.
29. Johnston SC, Fayad PB, Gorelick PB, et al. Prävalenz und Kenntnis der transitorischen ischämischen Attacke bei Erwachsenen in den USA. Neurologie. 2003 Mai 13;60(9): 1429-34.
30. Giles MF, Flossman E, Rothwell PM. Patientenverhalten unmittelbar nach transitorischer ischämischer Attacke nach klinischen Merkmalen, Wahrnehmung des Ereignisses und vorhergesagtem Schlaganfallrisiko. Schlaganfall. 2006 Mai;37(5):1254-60.
31. Rothwell PM, Giles MF, Flossmann E, et al. Ein einfacher Score (ABCD) zur Identifizierung von Personen mit hohem frühem Schlaganfallrisiko nach transitorischer ischämischer Attacke. Lancet. 2005 Juli 2-8;366(9479):29-36.
32. Tsivgoulis G, Spengos K, Manta P, et al. Validierung des ABCD-Scores bei der Identifizierung von Personen mit hohem frühem Schlaganfallrisiko nach transitorischer ischämischer Attacke: eine krankenhausbasierte Fallserienstudie. Schlaganfall. 2006 Dezember;37(12): 2892-7.
33. Tsivgoulis G, Stamboulis E, Sharma VK, et al. Multizentrische externe Validierung des ABCD2-Scores bei Triaging-TIA-Patienten. Neurologie. 2010 April 27;74(17): 1351-7.
34. Johnston SC, Rothwell PM, Nguyen-Huynh MN, et al. Validierung und Verfeinerung von Scores zur Vorhersage eines sehr frühen Schlaganfallrisikos nach transitorischer ischämischer Attacke. Lancet. 2007 Januar 27;369(9558): 283-92.
35. Chandratheva A, Geraghty OC, Luengo-Fernandez R, et al. Der ABCD2-Score sagt eher den Schweregrad als das Risiko eines frühen Wiederauftretens von Ereignissen nach einer vorübergehenden ischämischen Attacke voraus. Schlaganfall. 2010 Mai; 41(5): 851-6.