Finegoldia magna on täysin anaerobinen grampositiivinen kokkaasi, joka kuuluu ihon, suuontelon, ruoansulatuskanavan ja naisen urogenitaalisen alueen vastaavaan kasvistoon.1,2 kuvaamme epätavallinen tapaus monimutkainen gluteaalinen paise aiheuttama yksinomaan opportunistinen patogeeni potilaalla diabetes, joka ei ollut saanut aiemmin lihaksensisäisiä injektioita teennäinen.
päivystykseen tuli 60-vuotias mies, jolla oli voimakasta kipua ja märkimistä vasemmassa pakarassa, joka oli alkanut 2 viikkoa aiemmin. Potilaan aiempi historia sisälsi hypertensio, dyslipidemia, ylipaino (painoindeksi, 29), vitiligo, aktiivinen tupakointi (20 savuketta päivässä), ja tyypin 2 diabetes mellitus 12 vuotta kestäneen hyvän glykeemisen kontrollin ilman näyttöä metadiabeettisista komplikaatioista (HbA1, 7%), vaikka hän raportoi glykeemisen kontrollin heikkenemisestä kotona viime viikkoina, samaan aikaan tarttuvan prosessin kanssa. Potilas ei ole raportoinut aikaisempia pistoksia pakaralihakseen. Häntä hoidettiin asetyylisalisyylihapolla (100 mg/24 tuntia), atorvastatiinilla (10 mg/24 tuntia), glimepiridillä (2 mg/24 tuntia) ja bisoprololilla (5 mg/24 tuntia).
lääkärintarkastuksessa todettiin suuri, kivulias, kuuma vaihteleva turvotus vasemmassa pakarassa, johon liittyi krepitus ja aktiivinen märkiminen, sekä 10 cm: n nekroottinen alue (Kuva. 1). Laboratoriokokeet osoittivat seuraavaa: hemoglobiini, 15 g / dL; leukosyytit; 10 870 mm3; verihiutaleet, 121 000 mm3; protrombiiniaika, 16%; glukoosi, 370 mg / dL; urea, 67 mg / dL; kreatiniini, 1,25 mg / dL; maitohappo 2 mmol/L; prokalsitoniini 1, 19 ng/mL; C-reaktiivinen proteiini 249 mg/L.
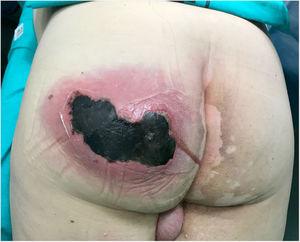
vasemman pakaralihaksen absessi, jossa on aktiivinen märkiminen ja suuri (10 cm) nekroosialue.
kliinisten löydösten perusteella potilaalle tehtiin salaojitus leikkaussalissa. Litra mätää poistettiin, näytteitä otettiin viljelyä varten ja nekroottisesta kudoksesta tehtiin laaja poisto. Leikkauksen aikana potilas osoitti suotuisaa kliinistä kurssia, palauttaa glykeemisen kontrollin sekä vasemman jalan liikkuvuuden ja toimivuuden.
Absessiviljelmät olivat negatiivisia aerobisille bakteereille ja positiivisia vain tiukasti anaerobisille grampositiivisille cocceille, joiden bakteerityypitys osoitti F magna: ksi. F Magnan antibioottikuuri paljasti herkkyyden amoksisilliinille-klavulaanihapolle, metronidatsolille ja klindamysiinille, eikä näyttöä antibioottiresistenssistä. Potilas kotiutettiin sairaalasta ja hänelle määrättiin antibioottihoitoa (metronidatsoli, 500 mg/8 h) ja avohoidon leikkaushaavoja, joihin hän reagoi hyvin.
F magna, joka tunnettiin aiemmin nimellä Peptostreptococcus magnus, on kokenut useita taksonomisia muutoksia sen jälkeen, kun Prevot kuvasi sen ensimmäisen kerran vuonna 1933 käyttäen termiä Diplococcus magnus.3
F magna on luultavasti yleisin kaikista grampositiivisista anaerobisista cocci (GPAC)-bakteereista ja patogeenisin muoto, joka löytyy ihmisen kliinisistä näytteistä. Tämä mikro-organismi on osa normaalia eliötä, ja sitä esiintyy pääasiassa ihossa, ruoansulatuskanavassa, naisen virtsatietulehduksessa ja vähäisemmässä määrin suuontelossa.1,2 viime vuosina on tunnistettu 2 tärkeää proteiinia, jotka selittävät F Magnan virulenssin ja kolonisaatiokyvyn: pintaliimaproteiini FAF (F magna adheesiokerroin) ja subtilisiinin kaltainen seriiniproteaasi SufA.2,4 orvaskeden ylemmissä kerroksissa FAF välittää adheesiota sitoutumalla galektiini-7: ään, joka on keratinosyyttisolumarkkeri. Kun bakteerit siirtyvät syvemmälle ihoon ja saavuttavat tyvikalvon, SufA hajottaa kollageenia IV. verinahassa FAF vuorovaikuttaa kollageeni V: n ja fibrilliinin kanssa, mikä oletettavasti selittää, miten F magna voi saavuttaa ihokudoksen syvimmät kerrokset infektion aikana.5
F magna on yksi niistä lajeista, joita viljellään yleisimmin ihon, pehmytkudosten, luiden ja nivelten paiseista, yleensä polymikrobiviljelmissä ja harvoissa tapauksissa puhtaissa viljelmissä.3 postoperatiivista mediastiniittia, proteesiläpän endokardiittia ja F Magnan aiheuttamaa nekrotisoivaa keuhkokuumetta on kuvattu.6 ihon mikrobistoa muuttavien laajakirjoisten antibioottien käyttö, vieraiden aineiden (proteesiläpät, korvausnivelet, katetrit) käyttöönotto ja immunosuppressiivisilla lääkkeillä hoidettujen potilaiden määrän kasvu suosivat näitä infektioita luomalla optimaalisen ympäristön näille opportunistisille patogeeneille.
anaerobisten bakteerien mikrobilääkeresistenssi lisääntyy maailmanlaajuisesti.7 useimmat GPAC: t (>90%) ovat herkkiä penisilliinille, ja monet ovat herkkiä myös muille β-laktaamiantibiooteille,7-10, mutta ne ovat lisääntyvässä määrin vastustuskykyisiä muille antibiooteille, kuten klindamysiinille, metronidatsolille ja fluorokinoloneille.8-10 Klindamysiiniresistenssin määrä GPAC-potilailla vaihtelee 7-20%: sta, mutta lisääntyy tietyillä lajeilla, kuten F magna-ja Peptoniphilus-lajeilla.7 useimmat GPAC: t ovat edelleen herkkiä metronidatsolille, vaikka joitakin metronidatsoliresistenttejä kantoja F magna ja Parvimonas micra on kuvattu.9
käsiteltävänä olevassa tapauksessa havainnollistetaan, miten vastaavanlainen bakteeri F magna pystyy tuottamaan pitkälle edenneen nekrotisoivan infektion, ja korostetaan, miten tärkeää on tunnistaa ja määrittää anaerobisten bakteerien mikrobilääkeherkkyys edustavista näytteistä, kun ne eristetään puhtaissa viljelmissä.
eturistiriidat
kirjoittajat ilmoittavat, ettei heillä ole eturistiriitoja.