L’effet Jahn–Teller, parfois également connu sous le nom de distorsion Jahn–Teller, décrit la distorsion géométrique des molécules et des ions associée à certaines configurations électroniques. Cet effet électronique est nommé d’après Hermann Arthur Jahn et Edward Teller, qui ont prouvé, en utilisant la théorie des groupes, que les molécules dégénérées orbitalement ne peuvent pas être stables. Le théorème de Jahn–Teller stipule essentiellement que toute molécule non linéaire avec un état fondamental électronique spatialement dégénéré subira une distorsion géométrique qui supprime cette dégénérescence, car la distorsion diminue l’énergie globale de la molécule.
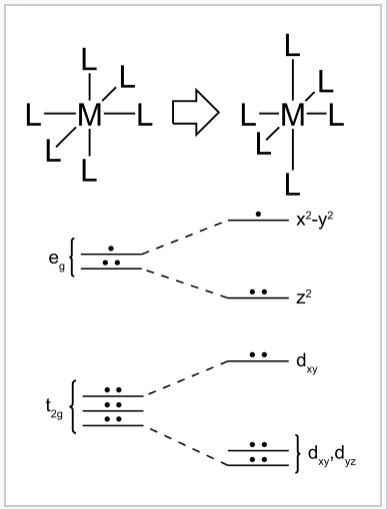
Distorsion de Jahn-Teller d’un complexe de métal de transition octaédrique d9. La distorsion tétragonale allonge les liaisons le long de l’axe z à mesure que les liaisons dans le plan x-y deviennent plus courtes. Ce changement abaisse l’énergie globale, car les deux électrons de l’orbitale dz2 diminuent en énergie lorsque l’électron de l’orbitale dx2-y2 monte.
Nous pouvons comprendre cet effet dans le contexte des complexes métalliques octaédriques en considérant les configurations d’électrons-d dans lesquelles l’ensemble orbital eg contient un ou trois électrons. Les plus courants sont d4 à spin élevé (par exemple, CrF2), d7 à spin faible (par exemple, NaNiO2) et d9 (par exemple, Cu2 +). Si le complexe peut se déformer pour briser la symétrie, alors l’une des orbitales (anciennement) dégénérées par exemple diminuera en énergie et l’autre montera. Plus d’électrons occuperont l’orbitale inférieure que la supérieure, ce qui entraînera un abaissement global de l’énergie électronique. Une distorsion similaire peut se produire dans les complexes tétraédriques lorsque les orbitales t2 sont partiellement remplies. De telles distorsions géométriques qui abaissent l’énergie électronique sont dites commandées électroniquement. Des distorsions similaires entraînées électroniquement se produisent dans les composés à chaîne unidimensionnels, où elles sont appelées distorsions de Peierls, et dans les feuilles liées à deux dimensions, où elles sont appelées ondes de densité de charge.
L’effet Jahn-Teller est le plus souvent rencontré dans les complexes octaédriques, en particulier les complexes de cuivre (II) à six coordonnées. La configuration électronique d9 de cet ion donne trois électrons dans les deux orbitales dégénérées eg, conduisant à un état fondamental électronique doublement dégénéré. De tels complexes se déforment le long d’un des quatre axes moléculaires (toujours étiquetés axe z), ce qui a pour effet d’éliminer les dégénérescences orbitales et électroniques et d’abaisser l’énergie globale. La distorsion prend normalement la forme d’un allongement des liaisons aux ligands situés le long de l’axe z, mais se produit occasionnellement comme un raccourcissement de ces liaisons (le théorème de Jahn–Teller ne prédit pas la direction de la distorsion, seulement la présence d’une géométrie instable). Lorsqu’un tel allongement se produit, l’effet est d’abaisser la répulsion électrostatique entre la paire d’électrons sur le ligand basique de Lewis et les électrons éventuels dans les orbitales à composante z, abaissant ainsi l’énergie du complexe. Si l’on s’attend à ce que le complexe non déformé ait un centre d’inversion, celui-ci est conservé après la distorsion.
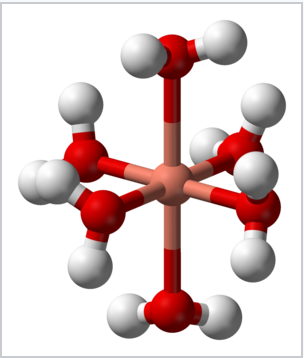
L’effet Jahn-Teller est responsable de la distorsion tétragonale de l’ion complexe hexaaquacopper(II), 2+, qui pourrait autrement posséder une géométrie octaédrique. Les deux distances axiales Cu-O sont 2.38 Å, alors que les quatre distances équatoriales Cu-O sont ~ 1,95 Å.
Dans les complexes octaédriques, l’effet Jahn-Teller est le plus prononcé lorsqu’un nombre impair d’électrons occupe les orbitales eg. Cette situation se produit dans des complexes avec les configurations d9, d7 à bas spin ou d4 à haut spin, qui ont tous des états fondamentaux doublement dégénérés. Dans de tels composés, les orbitales eg impliquées dans la dégénérescence pointent directement sur les ligands, de sorte que la distorsion peut entraîner une grande stabilisation énergétique. Strictement parlant, l’effet se produit également lorsqu’il y a une dégénérescence due aux électrons dans les orbitales t2g (c’est-à-dire des configurations telles que d1 ou d2, qui sont toutes deux triplement dégénérées). Dans de tels cas, cependant, l’effet est beaucoup moins perceptible, car il y a un abaissement beaucoup plus faible de la répulsion en éloignant les ligands des orbitales t2g, qui ne pointent pas directement sur les ligands (voir le tableau ci-dessous). Il en va de même dans les complexes tétraédriques (par exemple le manganate: la distorsion est très subtile car il y a moins de stabilisation à gagner car les ligands ne pointent pas directement sur les orbitales.
Les effets attendus pour la coordination octaédrique sont donnés dans le tableau suivant:
| Nombre d’électrons d | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Rotation Haute / Basse | HS | LS | HS | LS | HS | LS | HS | LS | ||||||
| Force de l’effet J-T | w | w | l | l | l | l | l | l | l | |||||
w : effet Jahn–Teller faible (orbitales t2g inégalement occupées)
s : effet Jahn-Teller fort attendu (par exemple orbitales inégalement occupées)
blanc : aucun effet Jahn–Teller attendu.
L’effet Jahn-Teller se manifeste dans les spectres d’absorbance UV-VIS de certains composés, où il provoque souvent la division des bandes. Il apparaît facilement dans les structures de nombreux complexes de cuivre (II). Des informations supplémentaires détaillées sur l’anisotropie de tels complexes et la nature de la liaison au ligand peuvent être obtenues à partir de la structure fine des spectres de résonance de spin électronique à basse température.
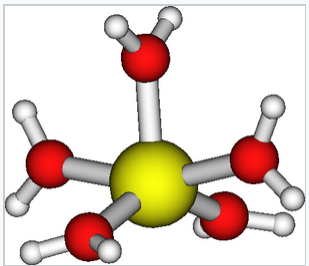
L’ion Cu(II) peut également coordonner cinq molécules d’eau dans une pyramide carrée allongée avec quatre liaisons Cu-Oeq (2×1,98 Å et 2×1,95 Å) et une longue liaison Cu-Oax (2,35 Å). Les quatre ligands équatoriaux sont déformés par rapport au plan équatorial moyen de ± 17°.