Je lisais récemment un article qui faisait référence au test de la fraction de shunt à 100% d’oxygène. Les résultats du test ont été inclus dans l’analyse des données, mais les équations utilisées par les chercheurs n’ont pas été présentées ni référencées, ni la procédure décrite. C’est probablement parce que le test de fraction de shunt et ses équations sont une physiologie pulmonaire très ancienne, mais même si le sujet est probablement traité à un moment ou à un autre dans des cours de physiologie, je soupçonne que certaines des questions impliquées dans le calcul ne sont pas aussi bien comprises qu’elles devraient l’être.
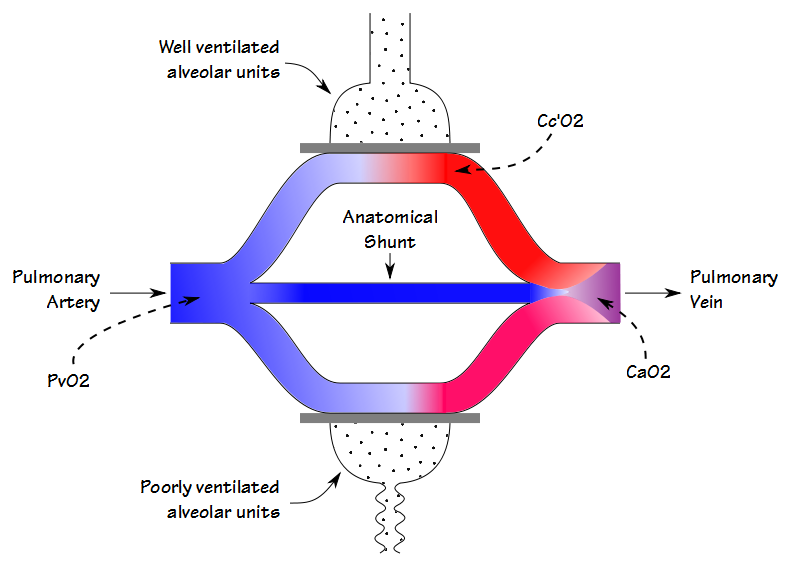
Il y a quelques similitudes entre le rapport espace mort-volume courant (Vd / Vt) et la fraction de shunt, mais même s’ils sont tous deux impliqués dans l’échange de gaz (et dans une certaine mesure, ils sont également en corrélation les uns avec les autres), ils mesurent des choses différentes. Lorsque le sang circule dans le poumon, du sang traverse des alvéoles bien ventilées et devient complètement saturé; du sang traverse des alvéoles mal ventilées et n’est que partiellement saturé; et certains contournent entièrement les alvéoles. La teneur en oxygène artériel résultante est la moyenne additionnée de tous ces compartiments.
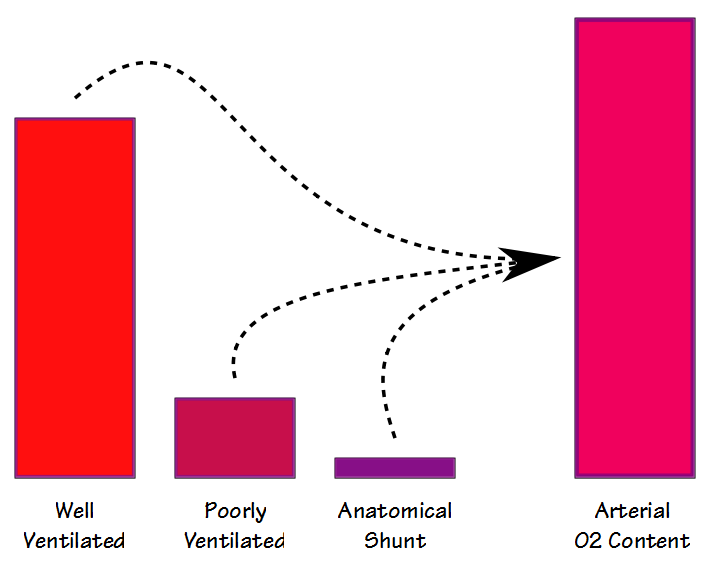
Il existe deux façons différentes de mesurer et de calculer la fraction de shunt: physiologique et anatomique. L’équation de shunt physiologique peut être effectuée à n’importe quel FiO2 (mais généralement autour du FiO2 de l’air ambiant) et nécessite que des échantillons de sang artériel et veineux mixtes soient prélevés plus ou moins simultanément, puis analysés pour le PO2 et le SaO2. La formule de base est:
Où:
Qs = flux sanguin par shunt
Qt = flux sanguin total
Cc’O2 = teneur en O2 capillaire pulmonaire
CaO2 = teneur en O2 artérielle
CvO2 = teneur en O2 veineuse mixte
La teneur en oxygène est les millilitres d’oxygène par litre de sang et est calculé à partir de:
Où:
Hb = hémoglobine (grammes / décalitre)
SO2 = saturation en oxygène (%)
PO2 = pression partielle d’oxygène
La teneur en O2 du capillaire pulmonaire ne peut pas être mesurée directement (et à proprement parler, il s’agit plus d’une valeur conceptuelle que réelle) et est généralement estimée à partir de l’équation de l’air alvéolaire (bien que le sang capillaire pulmonaire « idéal » présente un gradient de PO2 de environ 1 mm Hg de l’air alvéolaire est suffisamment insignifiant pour qu’il soit généralement ignoré).
Où:
Pb = pression barométrique en mm Hg
FiO2 = concentration fractionnaire d’oxygène inspiré
PaCO2 = pression partielle artérielle de CO2
RER = rapport d’échange respiratoire
La teneur en oxygène des capillaires pulmonaires est déterminée en estimant d’abord la saturation en oxygène à partir du PAO2 et cela peut être fait soit visuellement à partir du courbe de dissociation de l’oxygène:
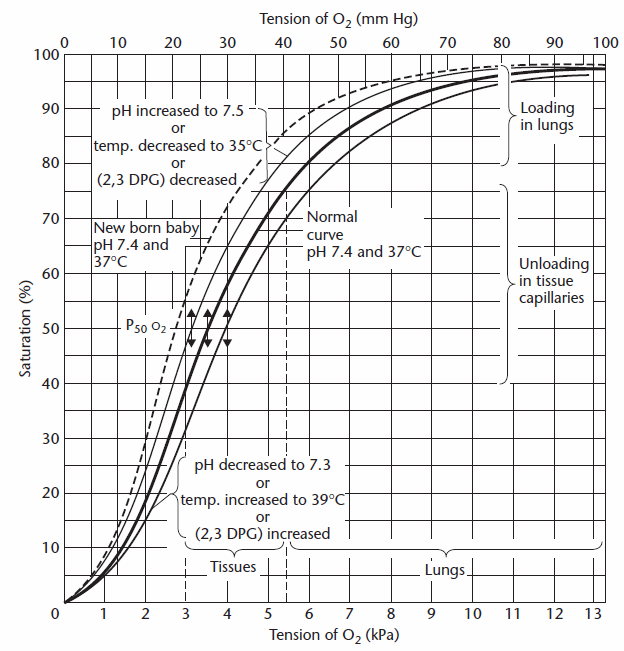
De Cotes et al, pg. 260.
ou de la formule de Severinghaus:
et ensuite calculer Cc’O2 en conséquence.
Remarque: Il est intéressant de noter que ni la courbe de dissociation de l’oxygène ni la formule de Severinghaus ne tiennent compte de la carboxyhémoglobine (ou de la méthémoglobine). D’ailleurs, cette question n’a été incluse dans aucune des discussions de manuel de fraction de shunt que j’ai lues. COHb biaise la relation entre PO2 et SO2 (vers le bas si vous travaillez de PO2 à SO2, vers le haut si vous travaillez de SO2 à PO2). Les niveaux normaux de COHb chez les non-fumeurs sont de 1 à 2 et il est peu probable que cette quantité de COHb fasse une différence significative dans les calculs de la fraction de shunt. En l’absence de lignes directrices fermes cependant, lorsque des niveaux plus élevés de COHb sont présents, ils devraient probablement être utilisés pour ajuster Cc’O2 en conséquence.
En prenant des valeurs normales et en travaillant en arrière, PAO2 est:
La saturation en oxygène capillaire pulmonaire est donc:
Et la teneur en oxygène capillaire pulmonaire est:
Le sang veineux mixte a nominalement un PO2 de 40 et une saturation en oxygène de 75%, donc:
CaO2 sera ensuite calculé à partir des PaO2 et SaO2 réels d’un individu. En fonction des résultats spécifiques, la fraction de shunt sera:
La fraction de shunt physiologique ne peut être calculée que lorsque les PO2 et SO2 artériels et mixtes veineux sont connus. Pour cette raison, il est le plus souvent effectué dans un laboratoire de catho cardiaque, une salle d’opération ou une unité de soins intensifs où les lignes artérielles et veineuses centrales sont relativement courantes. Le calcul du shunt physiologique ne permet cependant pas de faire la différence entre le shunt causé par des unités alvéolaires mal ventilées et celui d’un shunt anatomique. La fraction de shunt anatomique peut cependant être calculée par une procédure distincte, et c’est là que le test 100% O2 entre en jeu.
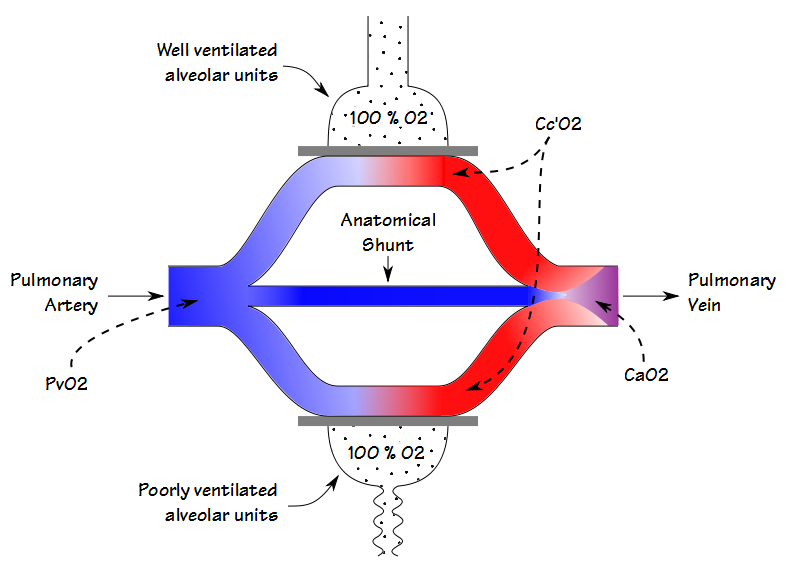
En faisant respirer un patient à 100% d’O2 jusqu’à ce que l’azote ait été éliminé de son poumon (nominalement 20 minutes), la concentration en oxygène dans des unités même mal ventilées approchera les 100%. Cela signifie que la pression partielle et la saturation du sang laissant à la fois les unités alvéolaires mal ventilées et bien ventilées seront les mêmes. Pour cette raison, toute diminution de la teneur en oxygène artériel sera due uniquement à un shunt anatomique.
Si un patient a un cathéter veineux central à demeure, le calcul du shunt anatomique peut se dérouler de la même manière que déjà détaillé. Si seul un échantillon artériel peut être obtenu (ce qui est généralement le cas dans un laboratoire PFT), une différence de teneur en O2 artério-veineuse comprise entre 4,4 et 5,0 peut être supposée et la fraction de shunt calculée en conséquence.
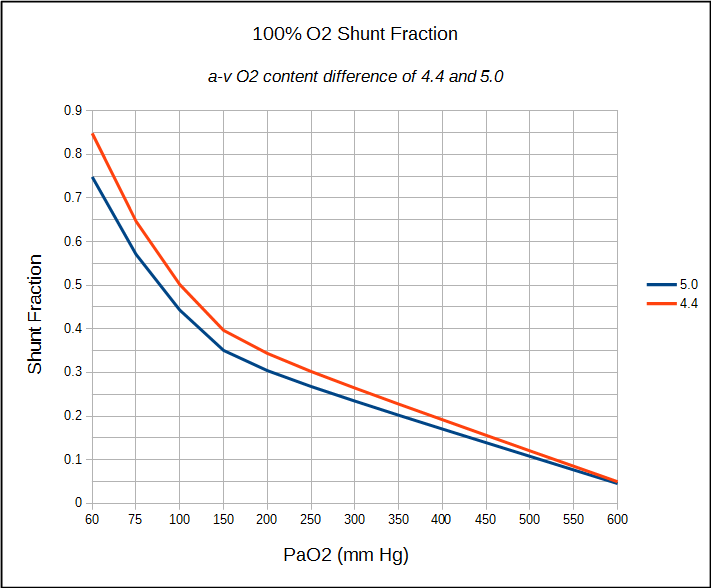
Les limites des calculs de fraction de shunt sont en partie liées à certaines hypothèses sur les valeurs normales et en partie à la précision des mesures des gaz sanguins. L’équation de l’air alvéolaire, par exemple, suppose que la ration d’échange respiratoire (RER) est de 0,8 mais la seule façon d’en être sûre est de mesurer réellement VO2 et VCO2. À proprement parler, un RER différent de 0,8 ne fera probablement pas de différence significative dans les PAO2, Sc’O2 et Cc’O2 calculés, mais c’est toujours une hypothèse. L’utilisation d’une différence de teneur en O2 a-v de 4,4 à 5,0, en revanche, est une hypothèse beaucoup plus grande. Il est justifié dans une certaine mesure par le fait que le test à 100% d’O2 est généralement effectué au repos et qu’il s’agit de valeurs raisonnables pour un individu au repos, mais encore une fois, il s’agit d’une hypothèse.
Les limites de la mesure précise du PaO2 et du SaO2, en particulier à des FiO2 plus élevés. Deux études différentes ont montré que le type de seringue utilisé pour obtenir un ABG (verre par rapport au plastique) et la façon dont il était stocké (sur glace ou à température ambiante) faisaient une différence significative dans la fraction de shunt calculée, même lorsque les échantillons d’ABG étaient analysés rapidement. Lorsqu’il y avait une attente plus longue avant l’analyse, l’erreur de PaO2 pouvait faire en sorte que la fraction de shunt calculée soit deux fois plus grande qu’elle ne l’était réellement. La raison pour laquelle cela se produit est en partie due à la diffusion à travers les seringues en plastique et en partie au métabolisme continu dans un échantillon de sang lorsqu’il est conservé à température ambiante. Le moins de changement a été observé lorsque les seringues en verre restaient sur la glace.
Fait intéressant, une étude similaire avec des échantillons ABG prélevés à FiO2 normal (PO2 ≈ 100) a montré l’effet inverse. Le PO2 mesuré avait tendance à augmenter, là encore plus dans les seringues en plastique que dans le verre, et là encore probablement en raison de la diffusion. Fait intéressant, le PO2 est tombé dans des seringues en verre conservées sur de la glace et les auteurs, Knowles et al, soulignent que la solubilité de l’O2 augmente à mesure que la température baisse et qu’avec plus d’O2 en solution, le PO2 peut diminuer.
Enfin, les analyseurs de gaz sanguins sont généralement étalonnés en utilisant des concentrations de gaz dans la plage physiologique normale. Tout échantillon de sang artériel avec un PO2 supérieur à 200 mm Hg est bien en dehors de cette plage et je suis préoccupé par le type de barre d’erreur qu’il y a pour les PO2 qui sont encore plus élevés. Pretto et al ont utilisé du sang tonométré avec 95% d’O2 et 5% de CO2, mais il est intéressant de noter qu’ils n’ont pas rapporté le PO2 mesuré, mais seulement le changement de PO2 au fil du temps. Smeenk et al ont obtenu des échantillons de sang de personnes subissant le test d’oxygène à 100% en tant qu’évaluation préopératoire pour un pontage coronarien et le PO2 moyen de leurs échantillons étalon-or (seringue en verre, glacé, délai de 5 minutes) était de 590 mm Hg. Il s’agit d’un gradient A-a d’environ 80 mm Hg et pourrait bien être approprié, mais cela signifie également que la fraction anatomique moyenne du shunt était de 10% et Cotes et al indique que le shunt anatomique normal pour les individus de la même tranche d’âge est d’environ 4%.
Le test de la fraction de shunt n’est pas couramment effectué dans les laboratoires de la fonction pulmonaire. Les vrais shunts anatomiques sont relativement rares et le patient le plus approprié pour le test de fraction de shunt O2 à 100% serait celui avec une SaO2 réduite au repos qui ne s’améliore pas de manière significative avec de l’O2 supplémentaire.
La fraction de shunt physiologique pourrait être considérée comme l’envers de Vd/Vt. Les inhomogénéités de perfusion existent tout autant que les inhomogénéités de ventilation, mais cela peut être négligé car les tests de la fonction pulmonaire sont beaucoup plus orientés du côté de la ventilation de la respiration que du côté de la perfusion. Les inhomogénéités de ventilation et de perfusion sont les principales caractéristiques de nombreuses maladies pulmonaires. Pour cette raison, la fraction de shunt et les différences entre ses composants physiologiques et anatomiques doivent faire partie de l’éducation de tous les technologues pulmonaires. Cependant, comme Vd / Vt, il existe également des limites à la précision du calcul de la fraction de shunt à la fois en raison d’hypothèses qui peuvent ou non être raisonnables et de la précision de la mesure du PO2 et du SO2.
Aboab J, Louis B, Jonson B, Brochard L. Relation entre PaO2 / FiO2 et FiO2: une description mathématique. Chapitre de Physiologie Appliquée en Médecine de Soins Intensifs, Pinsky MR, Brochard L, Mancebo JM éditeurs. La société Springer – Verlag Heidelberg, 2006.
Conrad SA, Kinasewitz GT, George RB. Test de la fonction pulmonaire. Principes et pratiques. Les éditions Churchill Livingston, 1984.
Cotes JE, Chinn DJ, Miller MR. Lung Function, 6e édition. Éditions Blackwell, 2006.
Knowles TP, Mullin RA, Hunter JA, Douce FH. Effets du matériel de seringue, du temps de stockage et de la température des échantillons sur les gaz sanguins et la saturation en oxygène dans les échantillons de sang humain artérialisé. Soins respiratoires 2006; 51(7): 732-736.
JJ Pretto, PD Rochford. Effets du temps de stockage de l’échantillon, de la température et du type de seringue sur les tensions des gaz sanguins dans les échantillons à haute pression d’oxygène. Thorax 1994; 49:610-612.
Smeenk FWJM, Janssen JDJ, Arends BJ, Harff GA, van den Bosch JA, Schonberger JPAM, Postmus PE. Effets de quatre méthodes différentes sur l’échantillonnage du sang artériel et le temps de stockage sur les tensions de gaz et le calcul du shunt dans le test à 100% d’oxygène. Eur Respir J 1997; 10:910-913.

Le blog PFT de Richard Johnston est sous licence Creative Commons Attribution – NonCommercial 4.0 International License