jeg leste en artikkel nylig som gjorde en off-hand referanse til 100% oksygen shunt fraksjon test. Resultatene fra testen ble inkludert i dataanalysen, men ligningene forskerne brukte ble ikke presentert, og de ble heller ikke referert, og prosedyren ble heller ikke beskrevet. Dette er sannsynligvis fordi shuntfraksjonstesten og dens ligninger er veldig mye gammeldags lungefysiologi, men selv om emnet sannsynligvis er dekket på en eller annen gang i fysiologiklasser, mistenker jeg at noen av problemene som er involvert i beregningen, ikke er så godt forstått som de burde være.
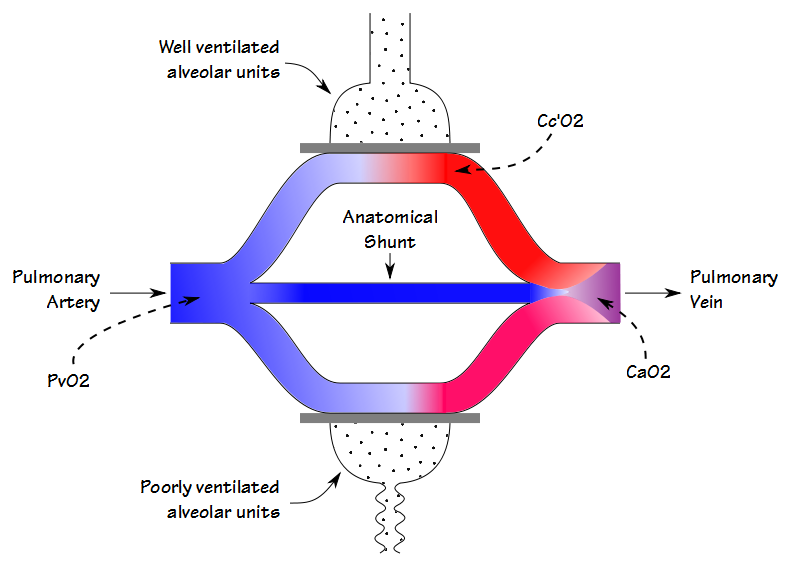
det er noen likheter mellom deadspace-tidevannsvolumforholdet (Vd / Vt) og shuntfraksjonen, men selv om de begge er involvert i gassutveksling (og til en viss grad korrelerer de også med hverandre) måler de forskjellige ting. Når blodet strømmer gjennom lungen, passerer noe blod gjennom godt ventilerte alveoler og blir fullstendig mettet; noe blod passerer gjennom dårlig ventilerte alveoler og er bare delvis mettet; og noen omgår alveolene helt. Det resulterende arterielle oksygeninnholdet er det summerte gjennomsnittet av alle disse rommene.
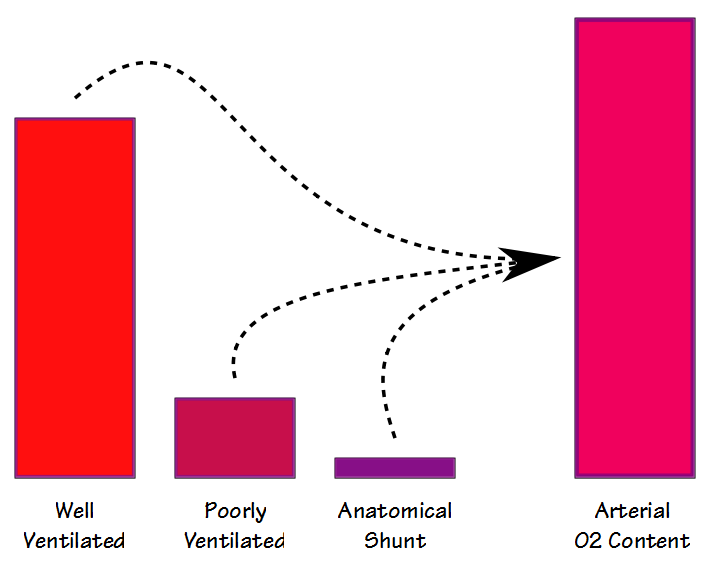
det er to forskjellige måter som shunt fraksjon kan måles og beregnes; fysiologiske og anatomiske. Den fysiologiske shunt-ligningen kan utføres ved Hvilken Som Helst FiO2 (men vanligvis Rundt fio2 i romluften) og krever at arterielle og blandede venøse blodprøver tas mer eller mindre samtidig og deretter analyseres FOR PO2 og SaO2. Den grunnleggende formelen er:
Hvor:
Qs = blodstrøm gjennom shunt
Qt = total blodstrøm
Cc ‘ O2 = lungekapillær o2 innhold
CaO2 = arteriell o2 innhold
CvO2 = blandet venøst o2 innhold
Oksygeninnhold er milliliter oksygen per liter blod og blod. beregnes fra:
Hvor:
Hb = hemoglobin (gram/decaliter)
SO2 = oksygenmetning (%)
PO2 = oksygenpartialtrykk
det pulmonale kapillære o2-innholdet kan ikke måles direkte (og strengt tatt er det mer av en konseptuell verdi enn en ekte) og er vanligvis estimert fra alveolar luftligningen (selv om «ideelt» lungekapillærblod har EN PO2-gradient på ca.1 mm hg fra alveolar luft dette er ubetydelig nok til At Det Vanligvis Ignoreres).
Hvor:
Pb = barometertrykk i mm Hg
FiO2 = fraksjonell konsentrasjon av inspirert oksygen
PaCO2 = arterielt partialtrykk AV CO2
RER = respiratorisk utvekslingsforhold
oksygeninnholdet i lungekapillærene bestemmes ved først å estimere oksygenmetningen FRA PAO2, og dette kan gjøres enten visuelt fra oksygen. dissosiasjonskurve:
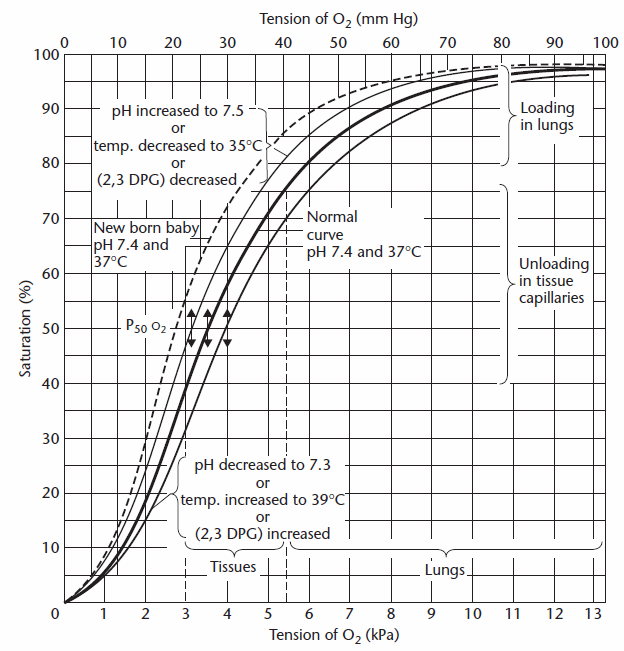
Fra Cotes et al, s. 260.
eller Fra Severinghaus ‘ s formel:
og deretter beregne Cc ‘ O2 tilsvarende.
Merk: Interessant verken oksygen dissosiasjon kurve Eller Severinghaus formel ta carboxyhemoglobin (eller methemoglobin) i betraktning. For den saks skyld har dette problemet ikke blitt inkludert i noen av lærebokdiskusjonene av shuntfraksjonen jeg har lest. COHb forskyver forholdet MELLOM PO2 OG SO2 (nedover hvis DU jobber FRA PO2 TIL SO2, oppover hvis DU jobber FRA SO2 TIL PO2). Normale Kohb-nivåer hos ikke-røykere er 1-2, og Denne Mengden Kohb er usannsynlig å gjøre en signifikant forskjell i shuntfraksjonsberegningene. I fravær av noen faste retningslinjer, men når høyere Nivåer Av COHb er til stede, bør de sannsynligvis brukes Til å justere Cc ‘ O2 tilsvarende.
Tar normale verdier og arbeider bakover, pao2 er:
lungekapillær oksygenmetning er derfor:
og lungekapillær oksygeninnhold er:
Blandet venøst blod har nominelt EN PO2 på 40 og en oksygenmetning på 75%, så:
CaO2 vil da bli beregnet ut fra en persons Faktiske PaO2 og SaO2. Avhengig av de spesifikke resultatene vil shuntfraksjonen være:
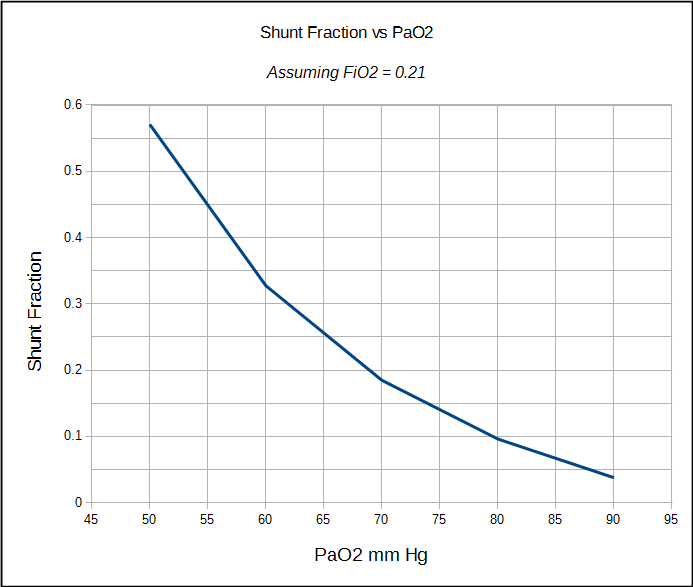
den fysiologiske shuntfraksjonen kan kun beregnes når både arteriell OG blandet venøs PO2 OG SO2 er kjent. Av denne grunn er det oftest utført i en cardiac cath lab, operasjonsstue eller intensivavdeling hvor iboende arterielle og sentrale venøse linjer er relativt vanlig. Den fysiologiske shuntberegningen kan imidlertid ikke skille mellom shunting forårsaket av dårlig ventilerte alveolære enheter og den fra en anatomisk shunt. Den anatomiske shuntfraksjonen kan beregnes ved en separat prosedyre, og det er her 100% O2-testen kommer inn i spill.
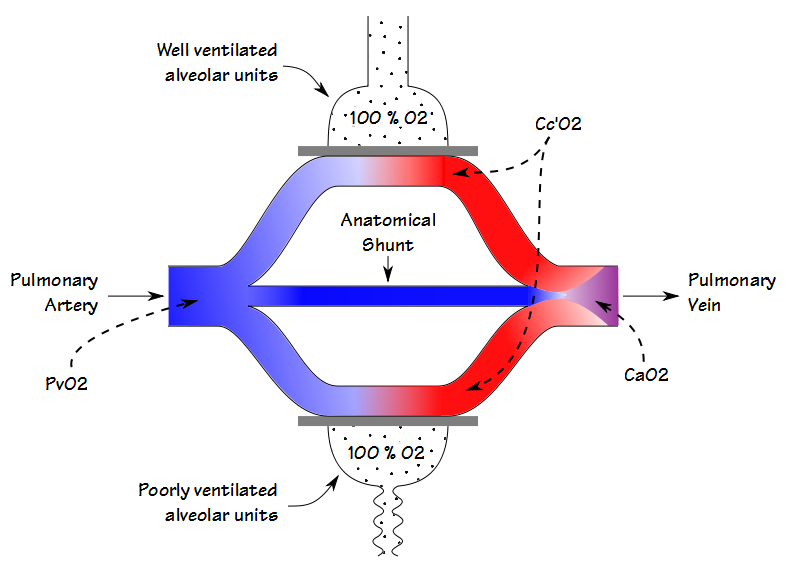
ved å la en pasient puste 100% O2 til nitrogenet har blitt vasket ut av lungen (nominelt 20 minutter), vil oksygenkonsentrasjonen i selv dårlig ventilerte enheter nærme seg 100%. Dette betyr at partialtrykket og metningen av blod som forlater både de dårlige og de godt ventilerte alveolære enhetene, vil være det samme. Av denne grunn vil enhver reduksjon i arterielt oksygeninnhold skyldes utelukkende en anatomisk shunt.
hvis en pasient har et innebygd sentralt venekateter, kan beregningen av anatomisk shunt fortsette på samme måte som allerede detaljert. Hvis bare en arteriell prøve kan oppnås (som vanligvis er tilfellet i ET Pft-Laboratorium), kan en arteriell-venøs o2 innholdsforskjell på mellom 4,4 og 5,0 antas, og shuntfraksjonen beregnes tilsvarende.
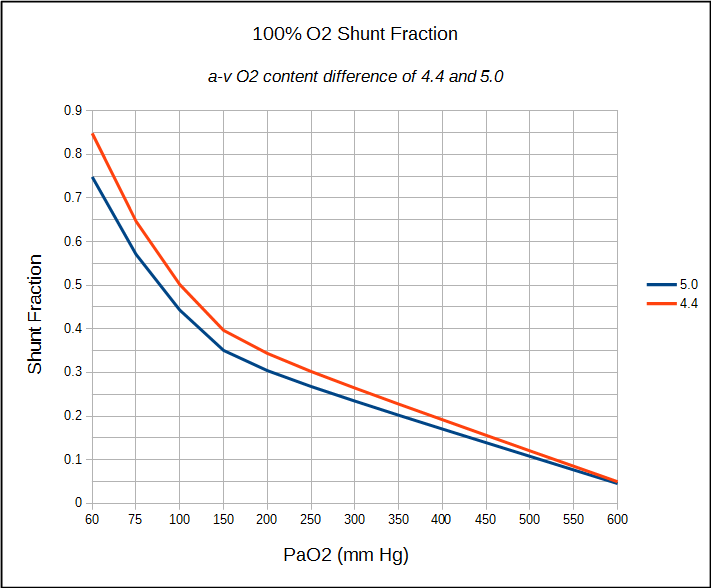
begrensningene i shuntfraksjonsberegningene må delvis gjøres med noen av antagelsene om normale verdier og delvis med nøyaktigheten av blodgassmålinger. Den alveolære luftligningen antar for eksempel at respiratorisk utvekslingsrasjon (RER) er 0,8, men den eneste måten å være sikker på er å faktisk måle VO2 og VCO2. Strengt tatt vil EN RER som er forskjellig fra 0,8 sannsynligvis ikke gjøre en betydelig forskjell i beregnet PAO2, Sc ‘O2 og Cc’ O2, men det er fortsatt en antagelse. Å bruke en a-v O2 innholdsforskjell på 4,4 til 5,0 derimot, er en mye større antagelse. Det er begrunnet til en viss grad av det faktum at 100% O2-testen vanligvis gjøres i ro, og disse er rimelige verdier for en person i ro, men igjen er det en antagelse.
langt mer om er begrensningene i nøyaktig måling Av PaO2 og SaO2, spesielt ved høyere FiO2. To forskjellige studier har vist at sprøytetypen som ble brukt til å oppnå EN ABG (glass versus plast) og hvordan den ble lagret (på is eller ved romtemperatur), gjorde en signifikant forskjell i den beregnede shuntfraksjonen selv når ABG-prøvene ble analysert raskt. Når det var lengre ventetid før analyse, kunne feilen I PaO2 føre til at den beregnede shuntfraksjonen var dobbelt så stor som den egentlig var. Årsaken til at dette skjer, skyldes delvis diffusjon gjennom plastsprøytene og delvis til fortsatt metabolisme i en blodprøve når den holdes ved romtemperatur. Den minste endringen ble sett når glasssprøyter holdt på is.
Interessant nok viste en lignende studie MED ABG-prøver tatt ved normal FiO2 (PO2 ≈ 100) motsatt effekt. DEN målte PO2 tendens til å stige, igjen mer i plastsprøyter enn i glass, og igjen dette trolig på grunn av diffusjon. Interessant, PO2 falt i glass sprøyter holdt på is og forfatterne, Knowles et al, påpeke at oppløseligheten Av O2 stiger som temperaturen faller, og at med Mer O2 i løsning PO2 kan redusere.
til Slutt kalibreres blodgassanalysatorer vanligvis ved bruk av gasskonsentrasjoner i det normale fysiologiske området. Enhver arteriell blodprøve MED PO2 over 200 mm Hg er godt utenfor dette området, og jeg er bekymret for hva slags feillinje det er FOR PO2 som er enda høyere. Pretto et al brukte blodtonometered med 95% O2 og 5% CO2, men interessant rapporterte de ikke den målte PO2, men bare endringen I PO2 over tid. Smeenk et al innhentet blodprøver fra personer som gjennomgår 100% oksygen test som en pre-op vurdering for koronar bypass kirurgi og gjennomsnittlig PO2 av deres gullstandard prøver (glass sprøyte, iset, 5 minutters forsinkelse) var 590 mm Hg. Dette er en a-a gradient på rundt 80 mm Hg og kan godt være hensiktsmessig, men det betyr også at den gjennomsnittlige anatomiske shuntfraksjonen var 10% og Cotes et al indikerer at den normale anatomiske shunt for personer i samme aldersgruppe er rundt 4%.
shuntfraksjonstesten utføres ikke vanligvis i lungefunksjonslaboratorier. Sanne anatomiske shunter er relativt sjeldne, og den mest passende pasient for 100% O2 shunt fraksjon test ville være en med en redusert SaO2 i ro som ikke vesentlig bedre med supplerende O2.
den fysiologiske shuntfraksjonen kan betraktes som baksiden Av Vd / Vt. Perfusjonsinhomogeniteter eksisterer like mye som ventilasjonsinhomogeniteter, men dette kan overses fordi lungefunksjonstesting er orientert langt mer rundt ventilasjonssiden av respirasjon enn perfusjonssiden. Ventilasjon og perfusjon inhomogeniteter er kjernefunksjoner i mange lungesykdommer. Av denne grunn må shuntfraksjonen og forskjellene mellom dens fysiologiske og anatomiske komponenter være en del av utdanningen av alle lungeteknologer. Som Vd / Vt er det imidlertid også begrensninger for nøyaktigheten av shuntfraksjonsberegningen både fra forutsetninger som kanskje eller ikke er rimelige, og fra målenøyaktigheten TIL PO2 og SO2.
Aboab J, Louis B, Jonson B, Brochard L. Forholdet Mellom PaO2 / FiO2 Og FiO2: en matematisk beskrivelse. Kapittel I Anvendt Fysiologi I Intensivmedisin, Pinsky MR, Brochard L, Mancebo jm redaktører. Springer-Verlag Heidelberg, 2006.
Conrad SA, Kinasewitz GT, George RB. Lungefunksjonstesting. Prinsipper og Praksis. Churchill Livingston Publishing, 1984.
Cotes JE, Chinn DJ, Miller Mr. Lungefunksjon, 6. Utgave. Blackwell Publishing, 2006.
Knowles TP, Mullin RA, Hunter JA, Douce FH. Effekter av sprøytemateriale, prøvelagringstid og temperatur på blodgasser og oksygenmetning i arterialiserte humane blodprøver. Respir Omsorg 2006; 51 (7): 732-736.
Pretto JJ, Rochford PD. Effekter av prøvelagringstid, temperatur og sprøytetype på blodgassspenninger i prøver med høyt oksygentrykk. Thorax 1994; 49: 610-612.
Smeenk FWJM, Janssen JDJ, Arends BJ, harff GA, van Den Bosch JA, Schonberger JPAM, Postmus PE. Effekter av fire forskjellige metoder på prøvetaking arteriell blod og lagringstid på gass spenninger og shunt beregning i 100% oksygen test. Eur Respir J 1997; 10: 910-913.

PFT Blog av Richard Johnston er lisensiert under En Creative Commons Navngivelse – Ikkekommersiell 4.0 Internasjonal Lisens