Ich habe kürzlich einen Artikel gelesen, in dem auf den 100% Sauerstoff-Shuntfraktionstest verwiesen wurde. Die Ergebnisse des Tests wurden in die Datenanalyse einbezogen, aber die von den Forschern verwendeten Gleichungen wurden weder vorgestellt noch referenziert, noch wurde das Verfahren beschrieben. Dies liegt wahrscheinlich daran, dass der Shuntfraktionstest und seine Gleichungen sehr altmodisch sind Lungenphysiologie Aber selbst wenn das Thema wahrscheinlich irgendwann im Physiologieunterricht behandelt wird, vermute ich, dass einige der Probleme, die mit der Berechnung verbunden sind, nicht so gut verstanden werden, wie sie sein sollten.
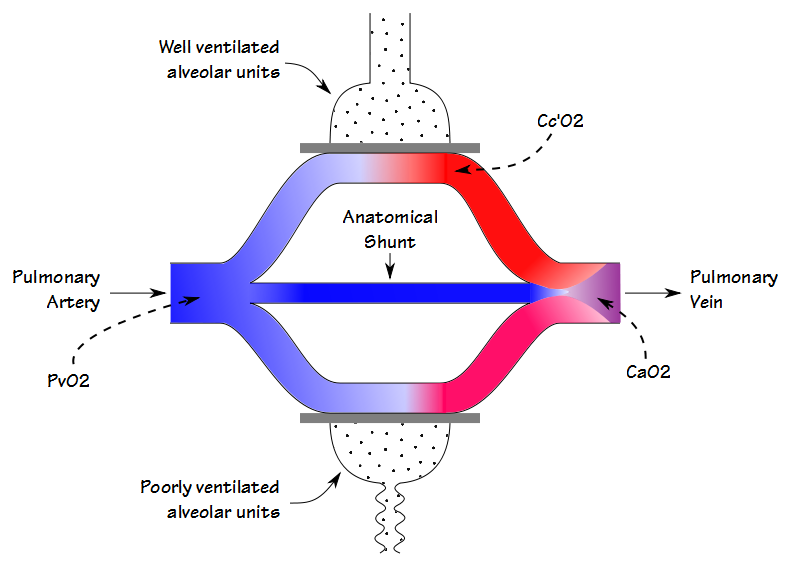
Es gibt einige Ähnlichkeiten zwischen dem Deadspace-Tidal Volume Ratio (Vd / Vt) und der Shunt-Fraktion, aber obwohl beide am Gasaustausch beteiligt sind (und in gewissem Maße auch miteinander korrelieren), messen sie unterschiedliche Dinge. Wenn Blut durch die Lunge fließt, passiert etwas Blut gut belüftete Alveolen und wird vollständig gesättigt; Etwas Blut passiert schlecht belüftete Alveolen und ist nur teilweise gesättigt; und einige umgehen die Alveolen vollständig. Der resultierende arterielle Sauerstoffgehalt ist der summierte Durchschnitt aller dieser Kompartimente.
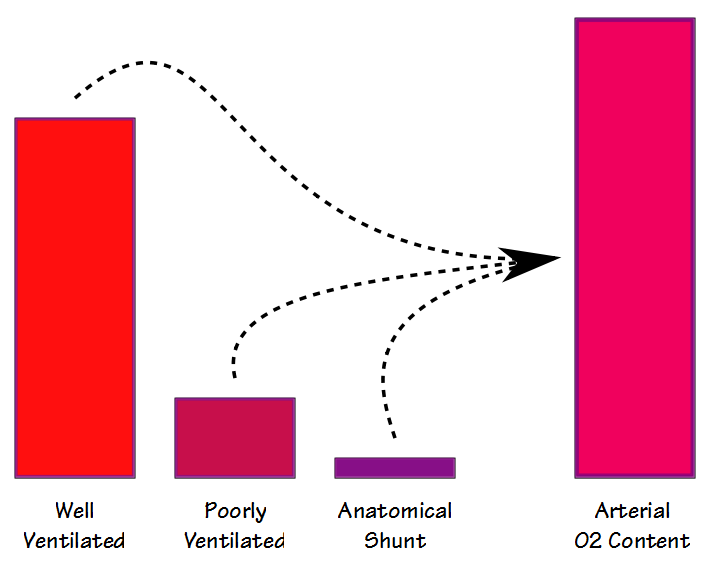
Es gibt zwei verschiedene Möglichkeiten, wie der Shunt-Anteil gemessen und berechnet werden kann. physiologisch und anatomisch. Die physiologische Shuntgleichung kann bei jedem FiO2 (aber normalerweise um das FiO2 der Raumluft) durchgeführt werden und erfordert, dass arterielle und gemischte venöse Blutproben mehr oder weniger gleichzeitig entnommen und dann auf PO2 und SaO2 analysiert werden. Die Grundformel lautet:
Wo:
Qs = Blutfluss durch Shunt
Qt = Gesamtblutfluss
Cc’O2 = pulmonaler kapillarer O2-Gehalt
CaO2 = arterieller O2-Gehalt
CvO2 = gemischt-venöser O2-Gehalt
Der Sauerstoffgehalt ist der Milliliter Sauerstoff pro Liter Blut blut und wird berechnet aus:
Wo:
Hb = Hämoglobin (Gramm / Dekaliter)
SO2 = Sauerstoffsättigung (%)
PO2 = Sauerstoffpartialdruck
Der pulmonale kapillare O2-Gehalt kann nicht direkt gemessen werden (und ist streng genommen eher ein konzeptioneller als ein realer Wert) und wird normalerweise aus der Alveolarluftgleichung abgeschätzt (obwohl „ideales“ pulmonales Kapillarblut einen PO2-Gradienten von etwa 1 mm aufweist Hg aus der Alveolarluft ist dies unbedeutend genug, dass es normalerweise ignoriert wird).
Wo:
Pb = Luftdruck in mm Hg
FiO2 = fraktionierte Konzentration des eingeatmeten Sauerstoffs
PaCO2 = arterieller Partialdruck von CO2
RER = respiratorisches Austauschverhältnis
Der Sauerstoffgehalt der Lungenkapillaren wird bestimmt, indem zuerst die Sauerstoffsättigung aus dem PAO2 abgeschätzt wird und dies entweder visuell aus dem Sauerstoffgehalt der Lungenkapillaren dissoziationskurve:
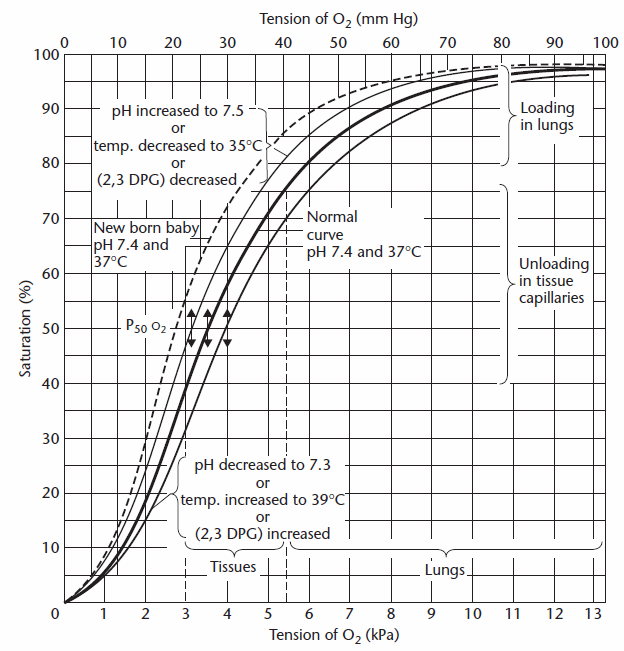
Aus Cotes et al, pg. 260.
oder nach Severinghaus’scher Formel:
und dann Cc’O2 entsprechend berechnen.
Hinweis: Interessanterweise berücksichtigen weder die Sauerstoffdissoziationskurve noch die Severinghaussche Formel Carboxyhämoglobin (oder Methämoglobin). Was das betrifft, wurde dieses Problem in keiner der Lehrbuchdiskussionen über Shuntfraktionen enthalten, die ich gelesen habe. COHb verzerrt die Beziehung zwischen PO2 und SO2 (nach unten, wenn Sie von PO2 zu SO2 arbeiten, nach oben, wenn Sie von SO2 zu PO2 arbeiten). Normale COHb-Spiegel bei Nichtrauchern liegen bei 1-2, und es ist unwahrscheinlich, dass diese Menge an COHb einen signifikanten Unterschied in den Shuntfraktionsberechnungen macht. In Ermangelung fester Richtlinien sollten jedoch höhere COHb-Spiegel wahrscheinlich verwendet werden, um Cc’O2 entsprechend anzupassen.
Unter normalen Werten und rückwärts arbeiten, ist PAO2:
Die pulmonale kapillare Sauerstoffsättigung ist daher:
Und der pulmonale kapillare Sauerstoffgehalt ist:
Gemischtes venöses Blut hat nominell einen PO2 von 40 und eine Sauerstoffsättigung von 75%, also:
CaO2 wird dann aus dem tatsächlichen PaO2 und SaO2 einer Person berechnet. Abhängig von den spezifischen Ergebnissen ist die Nebenschlussfraktion:
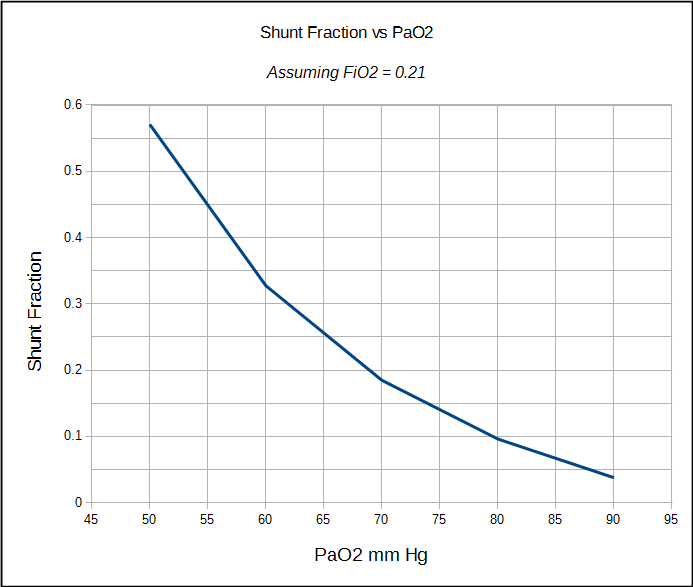
Die physiologische Shuntfraktion kann nur berechnet werden, wenn sowohl das arterielle als auch das gemischt-venöse PO2 und SO2 bekannt sind. Aus diesem Grund wird es am häufigsten in einem Herzkatheterlabor, Operationssaal oder Intensivstation durchgeführt, wo verweilende arterielle und zentralvenöse Linien relativ häufig sind. Die physiologische Shuntberechnung kann jedoch nicht zwischen dem durch schlecht belüftete Alveolareinheiten verursachten Shunt und dem eines anatomischen Shunts unterscheiden. Die anatomische Shuntfraktion kann jedoch durch ein separates Verfahren berechnet werden, und hier kommt der 100% O2-Test ins Spiel.
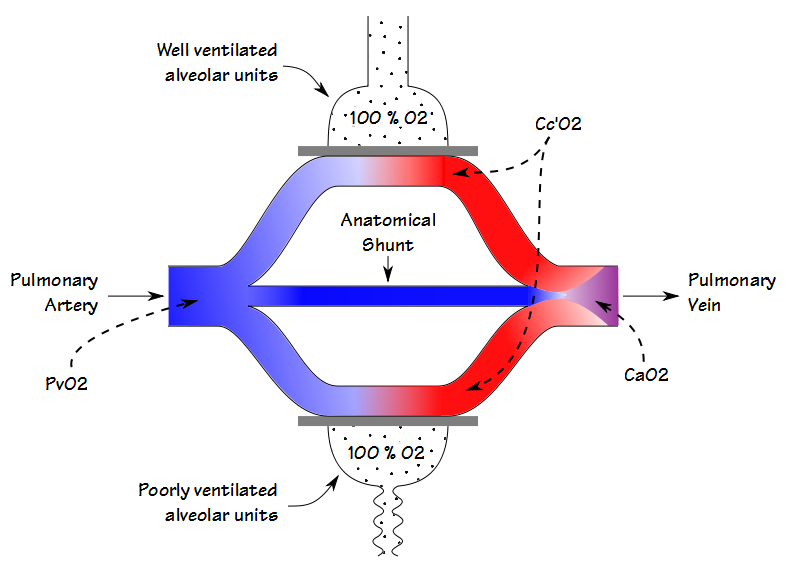
Wenn ein Patient 100% O2 atmet, bis der Stickstoff aus seiner Lunge ausgewaschen wurde (nominell 20 Minuten), nähert sich die Sauerstoffkonzentration selbst in schlecht belüfteten Einheiten 100%. Dies bedeutet, dass der Partialdruck und die Sättigung des Blutes, das sowohl die schlecht als auch die gut belüfteten Alveolareinheiten verlässt, gleich sind. Aus diesem Grund ist jede Abnahme des arteriellen Sauerstoffgehalts ausschließlich auf einen anatomischen Shunt zurückzuführen.
Wenn ein Patient einen verweilenden Zentralvenenkatheter hat, kann die Berechnung des anatomischen Shunts auf die gleiche Weise wie bereits beschrieben erfolgen. Wenn nur eine arterielle Probe entnommen werden kann (was in einem PFT-Labor normalerweise der Fall ist), kann von einer arteriell-venösen O2-Gehaltsdifferenz zwischen 4,4 und 5,0 ausgegangen und die Shuntfraktion entsprechend berechnet werden.
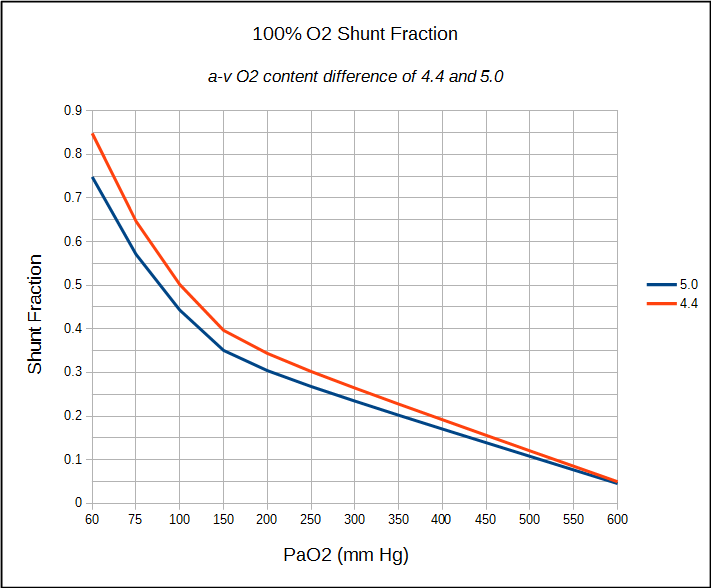
Die Einschränkungen der Shuntfraktionsberechnungen haben zum Teil mit einigen Annahmen über Normalwerte und zum Teil mit der Genauigkeit von Blutgasmessungen zu tun. Die Alveolarluftgleichung zum Beispiel geht davon aus, dass die Atmungsaustauschration (RER) 0,8 beträgt, aber die einzige Möglichkeit, sicher zu sein, besteht darin, VO2 und VCO2 tatsächlich zu messen. Streng genommen wird ein RER, der sich von 0,8 unterscheidet, wahrscheinlich keinen signifikanten Unterschied in berechnetem PAO2, Sc’O2 und Cc’O2 machen, aber es ist immer noch eine Annahme. Die Verwendung einer a-v O2 -Gehaltsdifferenz von 4,4 bis 5,0 ist dagegen eine viel größere Annahme. Es ist in gewissem Maße durch die Tatsache gerechtfertigt, dass der 100% O2-Test normalerweise in Ruhe durchgeführt wird und dies vernünftige Werte für eine Person in Ruhe sind, aber auch hier ist es eine Annahme.
Weitaus besorgniserregender sind die Einschränkungen bei der genauen Messung von PaO2 und SaO2, insbesondere bei höheren FiO2. Zwei verschiedene Studien haben gezeigt, dass die Art der Spritze, mit der ein ABG erhalten wurde (Glas im Vergleich zu Kunststoff) und wie es gelagert wurde (auf Eis oder bei Raumtemperatur), einen signifikanten Unterschied in der berechneten Shuntfraktion ausmachte, selbst wenn die ABG-Proben schnell analysiert wurden. Wenn vor der Analyse länger gewartet wurde, konnte der Fehler in PaO2 dazu führen, dass der berechnete Shunt-Anteil doppelt so groß war wie wirklich. Der Grund, warum dies geschieht, ist teilweise auf die Diffusion durch die Kunststoffspritzen und teilweise auf den fortgesetzten Metabolismus innerhalb einer Blutprobe zurückzuführen, wenn sie bei Raumtemperatur gehalten wird. Die geringste Veränderung wurde beobachtet, wenn Glasspritzen auf Eis gehalten wurden.
Interessanterweise zeigte eine ähnliche Studie mit ABG-Proben, die bei normalem FiO2 (PO2 ≈ 100) entnommen wurden, den gegenteiligen Effekt. Das gemessene PO2 stieg tendenziell an, wiederum stärker in Kunststoffspritzen als in Glas, und dies wiederum wahrscheinlich aufgrund von Diffusion. Interessanterweise fiel PO2 in Glasspritzen, die auf Eis gehalten wurden, und die Autoren Knowles et al. weisen darauf hin, dass die Löslichkeit von O2 mit fallender Temperatur ansteigt und dass PO2 mit mehr O2 in Lösung abnehmen kann.
Schließlich werden Blutgasanalysatoren üblicherweise mit Gaskonzentrationen im normalen physiologischen Bereich kalibriert. Jede arterielle Blutprobe mit PO2 über 200 mm Hg liegt weit außerhalb dieses Bereichs, und ich bin besorgt darüber, welche Art von Fehlerbalken es für PO2 gibt, die noch höher sind. Pretto et al verwendeten Bluttonometer mit 95% O2 und 5% CO2, aber interessanterweise berichteten sie nicht über das gemessene PO2, sondern nur über die Veränderung des PO2 im Laufe der Zeit. Erhaltene Blutproben von Personen, die sich dem 100% Sauerstofftest als präoperative Beurteilung für eine koronare Bypass-Operation unterzogen, und der durchschnittliche PO2 ihrer Goldstandardproben (Glasspritze, vereist, 5 Minuten Verzögerung) betrug 590 mm Hg. Dies ist ein A-a-Gradient von etwa 80 mm Hg und kann durchaus angemessen sein, aber es bedeutet auch, dass die durchschnittliche anatomische Shuntfraktion 10% betrug und Cotes et al.
Der Shuntfraktionstest wird in Lungenfunktionslabors nicht häufig durchgeführt. Echte anatomische Shunts sind relativ selten und der am besten geeignete Patient für den 100% igen O2-Shuntfraktionstest wäre ein Patient mit einem reduzierten SaO2 in Ruhe, der sich mit zusätzlichem O2 nicht signifikant verbessert.
Die physiologische Shuntfraktion könnte als die Rückseite von Vd / Vt betrachtet werden. Perfusionsinhomogenitäten existieren genauso wie Beatmungsinhomogenitäten, dies kann jedoch übersehen werden, da die Lungenfunktionsprüfung weit mehr auf der Beatmungsseite der Atmung als auf der Perfusionsseite ausgerichtet ist. Beatmungs- und Perfusionsinhomogenitäten sind Kernmerkmale vieler Lungenerkrankungen. Aus diesem Grund müssen die Shuntfraktion und die Unterschiede zwischen ihren physiologischen und anatomischen Komponenten Teil der Ausbildung aller Lungentechnologen sein. Wie Vd / Vt gibt es jedoch auch Einschränkungen für die Genauigkeit der Shuntfraktionsberechnung, sowohl aufgrund von Annahmen, die angemessen sein können oder nicht, als auch aufgrund der Messgenauigkeit von PO2 und SO2.
Aboab J, Louis B, Jonson B, Brochard L. Beziehung zwischen PaO2 / FiO2 und FiO2: eine mathematische Beschreibung. Kapitel in angewandter Physiologie in der Intensivmedizin, Pinsky MR, Brochard L, Mancebo JM Herausgeber. Springer-Verlag Heidelberg, 2006.
Conrad SA, Kinasewitz GT, George RB. Lungenfunktionstests. Prinzipien und Praxis. Churchill Livingston Publishing, 1984.
Cotes JE, Chinn DJ, Miller MR. Lungenfunktion, 6. Auflage. Blackwell Publishing, 2006.
Weiß TP, Mullin RA, Jäger JA, Douce FH. Auswirkungen von Spritzenmaterial, Probenlagerzeit und -temperatur auf Blutgase und Sauerstoffsättigung in arterialisierten menschlichen Blutproben. Respir Pflege 2006; 51(7): 732-736.
Pretto JJ, Rochford PD. Auswirkungen von Probenlagerzeit, Temperatur und Spritzentyp auf Blutgasspannungen in Proben mit hohem Sauerstoffdruck. Thorax 1994; 49: 610-612.
Smeenk FWJM, Janssen JDJ, Arends BJ, Harff GA, van den Bosch JA, Schonberger JPAM, Postmusik. Auswirkungen von vier verschiedenen Methoden auf die Probenahme von arteriellem Blut und die Lagerzeit auf Gasspannungen und Shuntberechnung im 100% Sauerstofftest. Eur bzw. 1997; 10: 910-913.

PFT Blog von Richard Johnston ist lizenziert unter einer Creative Commons Namensnennung-Nicht-kommerziell 4.0 International Lizenz