L’effetto Jahn–Teller, noto anche come distorsione Jahn-Teller, descrive la distorsione geometrica di molecole e ioni associata a determinate configurazioni di elettroni. Questo effetto elettronico prende il nome da Hermann Arthur Jahn e Edward Teller, che hanno dimostrato, usando la teoria dei gruppi, che le molecole degenerate orbitalmente non possono essere stabili. Il teorema di Jahn–Teller afferma essenzialmente che qualsiasi molecola non lineare con uno stato fondamentale elettronico spazialmente degenerato subirà una distorsione geometrica che rimuove quella degenerazione, perché la distorsione abbassa l’energia complessiva della molecola.
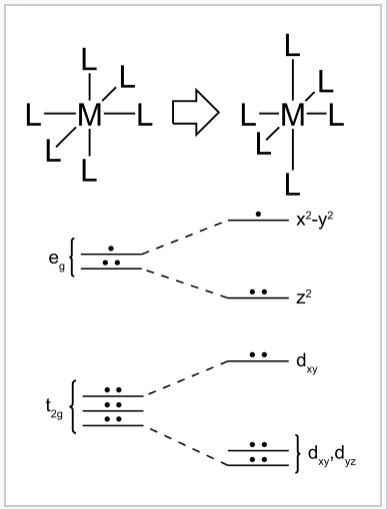
Distorsione di Jahn-Teller di un complesso ottaedrico del metallo di transizione d9. La distorsione tetragonale allunga i legami lungo l’asse z mentre i legami nel piano xy si accorciano. Questo cambiamento abbassa l’energia complessiva, perché i due elettroni nell’orbitale dz2 scendono in energia mentre l’elettrone nell’orbitale dx2-y2 sale.
Possiamo comprendere questo effetto nel contesto dei complessi metallici ottaedrici considerando le configurazioni d-electron in cui l’insieme orbitale eg contiene uno o tre elettroni. I più comuni di questi sono high spin d4 (ad esempio , CrF2), low spin d7 (ad esempio, NaNiO2), e d9 (ad esempio, Cu2+). Se il complesso può distorcere per rompere la simmetria, allora uno degli orbitali (precedentemente) degenerati ad esempio scenderà in energia e l’altro salirà. Più elettroni occuperanno l’orbitale inferiore rispetto a quello superiore, con un conseguente abbassamento complessivo dell’energia elettronica. Una distorsione simile può verificarsi nei complessi tetraedrici quando gli orbitali t2 sono parzialmente riempiti. Si dice che tali distorsioni geometriche che abbassano l’energia elettronica siano guidate elettronicamente. Simili distorsioni guidate elettronicamente si verificano in composti a catena unidimensionali, dove sono chiamati distorsioni Peierls, e in fogli bidimensionali, dove sono chiamati onde di densità di carica.
L’effetto Jahn–Teller si incontra più spesso nei complessi ottaedrici, in particolare nei complessi di rame(II) a sei coordinate. La configurazione elettronica d9 di questo ion dà tre elettroni nei due orbitali degenere eg, portando ad uno stato fondamentale elettronico doppiamente degenere. Tali complessi distorcono lungo uno dei quattro assi molecolari (sempre etichettato l’asse z), che ha l’effetto di rimuovere le degenerazioni orbitali ed elettroniche e abbassare l’energia complessiva. La distorsione assume normalmente la forma di allungare i legami ai ligandi che si trovano lungo l’asse z, ma occasionalmente si verifica invece come un accorciamento di questi legami (il teorema di Jahn–Teller non prevede la direzione della distorsione, solo la presenza di una geometria instabile). Quando si verifica un tale allungamento, l’effetto è quello di abbassare la repulsione elettrostatica tra la coppia di elettroni sul ligando di base di Lewis e gli eventuali elettroni negli orbitali con un componente z, riducendo così l’energia del complesso. Se ci si aspetta che il complesso non distorto abbia un centro di inversione, questo viene mantenuto dopo la distorsione.
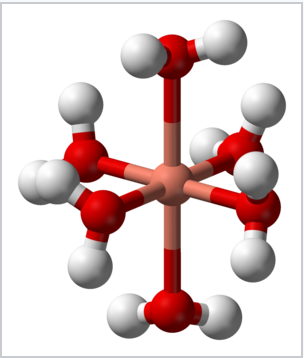
L’effetto Jahn-Teller è responsabile della distorsione tetragonale dello hex complesso hexaaquacopper (II), 2+, che altrimenti potrebbe possedere geometria ottaedrica. Le due distanze Cu-O assiali sono 2.38 Å, mentre le quattro distanze Cu-O equatoriali sono ~1,95 Å.
Nei complessi ottaedrici, l’effetto Jahn–Teller è più pronunciato quando un numero dispari di elettroni occupa gli orbitali eg. Questa situazione si verifica nei complessi con le configurazioni d9, low-spin d7 o high-spin d4 complessi, che hanno tutti stati di terra doppiamente degenerati. In tali composti gli orbitali eg coinvolti nella degenerazione puntano direttamente ai ligandi, quindi la distorsione può provocare una grande stabilizzazione energetica. A rigor di termini, l’effetto si verifica anche quando c’è una degenerazione dovuta agli elettroni negli orbitali t2g (cioè configurazioni come d1 o d2, entrambe triplicate). In questi casi, tuttavia, l’effetto è molto meno evidente, perché c’è un abbassamento molto più piccolo della repulsione nel prendere i ligandi più lontano dagli orbitali t2g, che non puntano direttamente ai ligandi (vedi la tabella sotto). Lo stesso vale per i complessi tetraedrici (ad esempio manganato: la distorsione è molto sottile perché c’è meno stabilizzazione da ottenere perché i ligandi non puntano direttamente agli orbitali.
Gli effetti attesi per la coordinazione ottaedrica sono riportati nella seguente tabella:
| Numero di elettroni d | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Alta/Bassa Rotazione | HS | LS | HS | LS | HS | LS | HS | LS | ||||||
| la Forza di J-T Effetto | w | w | s | w | w | w | w | s | s | |||||
w: debole Jahn–Teller effetto (orbitali t2g irregolarmente occupati)
s: forte Jahn–Teller effetto atteso (ad esempio orbitali irregolarmente occupati)
vuoto: non Jahn–Teller effetto previsto.
L’effetto Jahn–Teller si manifesta negli spettri di assorbanza UV-VIS di alcuni composti, dove spesso causa la scissione delle bande. È facilmente evidente nelle strutture di molti complessi di rame(II). Ulteriori informazioni dettagliate sull’anisotropia di tali complessi e sulla natura del legame del ligando possono essere ottenute dalla struttura fine degli spettri di risonanza di spin di elettroni a bassa temperatura.
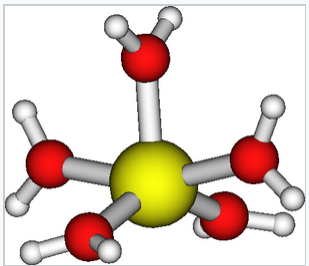
Lo ion Cu(II) può anche coordinare cinque molecole d’acqua in una piramide quadrata allungata con quattro legami Cu-Oeq (2×1, 98 Å e 2×1, 95 Å) e un lungo legame Cu-Oax (2,35 Å). I quattro ligandi equatoriali sono distorti dal piano equatoriale medio di ± 17°.