- Hypofosforsyre Kjemiske Egenskaper, Bruksområder, Produksjon
- Outline
- Kjemiske egenskaper
- Bruker
- Toksisitet
- FAREIDENTIFIKASJON
- Tilberedningsmetode
- Produksjonsmetode
- Beskrivelse
- Beskrivelse
- Kjemiske Egenskaper
- Fysiske egenskaper
- Bruker
- Definisjon
- Fremstilling
- Produksjonsmetoder
- Definisjon
- Reaksjoner
- Generell Beskrivelse
- Luft & Vannreaksjoner
- Reaktivitetsprofil
- Fare
- Helsefare
- Brannfare
- Rensemetoder
Hypofosforsyre Kjemiske Egenskaper, Bruksområder, Produksjon
Outline
Hypofosforsyre er også kjent som «hypofosfitt» Det er fargeløs olje eller deliquescence krystall, det er et viktig fint kjemisk produkt. Hovedbruken er som reduksjonsmiddel for elektrofri plating, fosfor forhindrer misfarging av harpikser, det kan også brukes i forestringsreaksjonskatalysatoren, kjølemediet, spesielt for produksjon av natriumhypofosfitt med høy renhet. Det finnes flere metoder for forberedelse, den vanlige industrielle metoden for produksjon er ionbytterharpiksmetode og elektrodialysemetode.
de kjemiske egenskapene til hypofosforsyre, bruksområder, toksisitet og produksjonsmetoder er redigert av andy Of Chemicalbook. (2016-12-04)
Kjemiske egenskaper
det er deliquescent krystaller eller fargeløs olje. Smeltepunkt: 26.5℃ Den relative tettheten( spesifikk vekt): 1.439(solid, 19℃). Det er løselig i vann, etanol og eter, og det kan blandes i alle forhold med vann, etanol, aceton. I luften deles det lett til sirupaktig væske, og den vandige løsningen er sur.
Hypofosforsyre er monobasisk syre, i vandig oppløsning Er Hypofosforsyre sterk syre, Ka = 10-2 (25℃); den er relativt stabil ved romtemperatur; uforholdsmessig reaksjon kan fortsette ved 130℃, dekomponeres i fosfin og fosforsyre:
2H3PO2=H3PO4+PH3
den har sterk reduksjon, tungmetall saltløsning kan gjenopprettes til metaller Som Cu2+, Hg2+, Ag+, slik as:
4Ag+H3PO2+2H2)=4AG+H3PO4+4H+
det er svakt oksidasjonsmiddel, det kan reduseres til fosfin, fosfin når det møter sterkt reduksjonsmiddel.
Bruker
1. Hypofosforsyre brukes som reduksjonsmiddel for elektrofri plating;
2. Det kan brukes til å forhindre misfarging av fosforsyre harpiks;
3. Den brukes som forestringskatalysator, kjølemediet;
4. Det brukes til å produsere hypofosfitt, natriumsalter, mangansalter, jernsalter brukes vanligvis som nærende stoffer;
5. Hypofosforsyre brukes i medisin og som reduksjonsmiddel, bestemmelse av arsen, tellur og separasjon av tantal, niob og andre reagenser.
6. Det er sterkt reduksjonsmiddel, det kan brukes til fremstilling av natriumhypofosfitt, kalsiumfosfat og annen hypofosfitt.
7. Den kan brukes til plating bad. Legemidler. reduksjonsmiddel. generelle reagenser.
8. Det er sterkt reduksjonsmiddel, det kan brukes til å lage natriumhypofosfitt, kalsiumfosfat og annen hypofosfitt.
9. Dette produktet er mye brukt som reduksjonsmiddel, Ag, Cu, Ni, Hg og andre metaller reduseres til tilsvarende metall, for verifisering Av As, Nb, Ta Og andre reagenser, det kan brukes Til fremstilling Av Na, K, Ca, Mn, Fe og andre typer hypofosfitt.
Toksisitet
det er ikke brennbart. Men når kontakt med hull h agent, vil det føre til brann. Når møter oksidasjonsmiddel, kan voldsom reaksjon og forbrenning fortsette. Når den er oppvarmet til høy, kan den dekomponere i svært giftig fosfingass, eller til og med eksplodere. Det er etsende. Hypofosforsyre blir ofte tilsatt i brus, og fordi den ikke absorberes. Så risikoen er liten, men spesielt sterk hypofosfitt skadet gastrointestinal. Tilfeldigvis spruter det i øynene eller kontakter huden, rikelig med vann brukes til å vaskes. Produksjonsoperatører bør bruke verneklær og andre verneklær. Produksjonsutstyr skal være forseglet, verkstedet skal ventileres godt.
FAREIDENTIFIKASJON
Faresetning:
Gir alvorlige etseskader på hud og øyne.
Forårsaker alvorlig øyeskade
Forholdsregler:
ikke pust inn støv/røyk/gass/tåke/damp / spray.
Vask grundig etter håndtering.
Bruk vernehansker og øye – /ansiktsbeskyttelse.
Ved SVELGING: Skyll munnen. Ikke fremkall brekninger.
VED HUDKONTAKT (eller hår): alle tilsølte klær Må Fjernes/fjernes umiddelbart. Skyll huden med vann / dusj.
Ved KONTAKT MED ØYNENE: Skyll forsiktig med vann i flere minutter. Fjern kontaktlinser, hvis
til stede og lett å gjøre. Fortsett å skylle.
VED INNÅNDING: fjern offeret i frisk luft og hold deg i ro i en stilling som er behagelig å puste.
kontakt UMIDDELBART ET GIFTINFORMASJONSSENTER eller lege.
Lagre låst opp.
Dette materialet Og dets beholder Skal Avhendes til farlig avfall eller spesialavfall.
Tilberedningsmetode
1. Fosfor – og bariumhydroksidoppløsning oppvarmes, bariumsalt Ba (H2PO2) 2 • 2H2O kan generere, svovelsyre tilsettes i hypofosforsyre bariumoppløsning, Ba2 + kan utfelle:
Ba (H2PO2) 2+H2SO4=BaSO4 + 2H3PO2
Hypofosforsyre kan oppnås ved fordampning under redusert trykk og lavtemperaturkrystallisering. På grunn av i denne prosessen er løseligheten av bariumsaltet liten, så konsentrasjonen av oppnådd Hypofosforsyre er ikke høy, industriprodukt skal renses ved omkrystallisering.
2. bariumoksidet (eller kalk) og løsningen av hvitt fosfor oppvarmes sammen for å danne sekundært bariumfosfat (eller kalsium), og reagerer deretter med svovelsyre, det filtreres, konsentreres for å oppnå produkt, eller natriumhypofosfittoppløsning fortsetter h-type ionbytterharpiks kan utlede produkt. Denne metoden krever en stor mengde harpiks, og harpiksregenerering og vasketrinn er tungvint, det koster vanligvis mer enn $ 7 per pund, det er bare egnet for liten batchproduksjon, og ikke egnet for store industrielle applikasjoner.
3. Hypofosforsyre fremstilles ved elektrodialysemetode, hvor elektrodialysecellen deler seg i tre deler, de er anodekammer, råmaterialekammer og katodekammer, mellomproduktet separeres av anionisk membran og kationisk membran, mellom to membraner er natriumhypofosfittoppløsning plassert (konsentrasjon av 100g/l~500g/L), anodekammer er fortynnet løsning av Hypofosforsyre 5g/L, anodekammer er fortynnet natriumhydroksydløsning ( 5g /L), MELLOM polene DC (3V~36V) er passert, anode frigjør oksygen, og genererer sekundært produkt av hypofosforsyre; katode avgir hydrogen og genererer sekundært produkt av natriumhydroksid, reaksjonstiden er 3~21h. reaksjonene av anodekammer og katodekammer er som følger:
anodekammer:
H2O==H++OH-
2OH-==O2+2h2o+4e
H++H2PO2-==H3PO2
katodekammer:
H2O==H++oh-
2h++2e==h2
na++oh-==naoh
elektrodialyse fremstillingsmetode hypofosforsyre er enkel og utstyrsinvestering ER LITEN, DEN ER EGNET FOR MASSEPRODUKSJON.
4. Fra den industrielle karakteren natriumhypofosfitt, Cl -, SO42-anioner som påvirker kvalitetsindikatorene For Hypofosforsyre, fjernes ved utfelling, tungmetallioner fjernes fra løsningen ved å danne sulfid, og deretter bruke sterk syre kationbytterharpiks for å oppnå natrium sekundært fosfat, kan høy renhetskvalitetsprodukt oppnå. Prosessen kan produsere høyverdig sekundær fosfat, teknisk er mulig, prosessen er enkel, enkel betjening, god produktkvalitet, den kan møte behovene til elektronikkindustrien, forsvarsindustrien og andre høyteknologiske felt.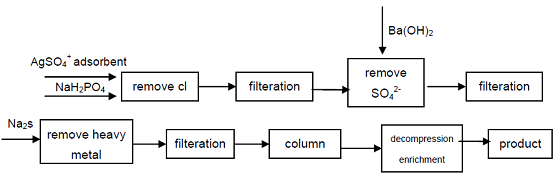
figur 1 Produksjonsprosess Av Hypofosforsyre fra Industriell Natriumhypofosfitt.
5. Ionbytterharpiksmetode: omtrent 70g kationbytterharpiks fuktet med vann pakkes inn i et glassrør med 5 mol / L saltsyre som sirkulerer om 15min, etter grundig vasket med vann, høy renhetsgrad vandig natriumhypofosfitt vandig løsning (15 g/60 ml H2O) strømmer gjennom den, harpikskolonnen vaskes først med 50 ml, deretter med 25 rnl destillert vann. Avløpsyren og vasken er kombinert, den er konsentrert ved fordampning i vannbad. Konsentrert syre er plassert i høyvakuum Med p205 tørketrommel for dehydrering, kjøling og krystallisering, filtrering, omkrystallisering, for å oppnå hypophosphorous syre produkt.
Produksjonsmetode
Ionbytterharpiks metode: sett om 70 g vannløselige kationbytterharpikser for å fylle i et glassrør. Sirkulere med 5 mol/L saltsyre i ca 15 min og vask tilstrekkelig med vann. Ha en høy vandig natriumhypofosfittløsning (15 g/60 ml H2O) for å strømme gjennom harpikskolonnen, etterfulgt av å bli vasket først med 50 ml vann og deretter skyllet med 25 rnl destillert vann. Avløpsyren og vaskene ble kombinert og konsentrert ved fordampning på et vannbad. Konsentrert syre sendes til svært vakuum, p205 tørketrommel for dehydrering, etterfulgt av kjøling krystallisering, filtrering og omkrystallisering å få det ferdige produktet av hypophosphorous syre.
Beskrivelse
Hypofosforsyre er et kraftig reduksjonsmiddelmed en molekylformel AV H3PO2. Uorganiske kjemikerereferer til den frie syren ved dette navnet, selv om Dets IUPACname er dihydridohydroxidooxidophosphorus, eller det akseptable navnet på fosfinsyre. Det er en fargeløslavsmeltende forbindelse, som er løselig i vann, dioksan og alkoholer. Formelen for hypofosforsyre er vanligvis skrevet H3PO2, men EN mer beskrivende presentasjon ER HOP (O)H2 som fremhever sin monoprotiske karakter. Salter avledet fra denne syrenkalles fosfater (hypofosfitter).
Beskrivelse
denne syren har den generelle formelen ofH4P2O6 og er forskjelligfra de andre oksyfososyrene. Den har mange peculiarities.It dannes sammen med fosfor og fosforsyre, når fosfor oksyderes av fuktig luft.Hvis hvitt fosfor er utsatt for luft, og natriumacetattil væskensom danner, det noe uoppløseligenatriumhypofosfat, Na2H2P2O6 * 6h2oseparater. Natriumhypofosfatmonohydrat er imidlertid svært løselig og deliquescent ved ~98,7 g/100 ml.
Kjemiske Egenskaper
fargeløs væske
Fysiske egenskaper
Fargeløse deliquescent krystaller eller oljeaktig væske; sur lukt; tetthet 1,493 g / cm3; smelter ved 26,5°C; koker ved 130°C; meget løselig i vann, alkohol Og eter; tetthet av en 50% vandig løsning er 1,13 g / mL.
Bruker
Fremstilling av hypofosfitter, galvaniseringsbad.
Definisjon
ChEBI: en fosforoksosyre som består av et enkelt pentavalent fosfor kovalent bundet via enkeltbindinger til to hydrogener og en hydroksygruppe og via en dobbeltbinding til et oksygen. Foreldre av klassen av fosfinsyrer.
Fremstilling
Hypofosforsyre kan fremstilles ved forskjellige metoder:
1. Kokende hvitt fosfor med kalsiumhydroksid:
P4 + 4ca (OH) 2 + 8H2O → 4ca (H2PO2) 2 + 4H2
kalsiumsaltet er løselig i vann. Behandling med svovelsyre gir hypofosforsyre:
(H2PO2) 2ca + H2SO4 → 2H3PO2 + CaSO4
produktblandingen filtreres for å fjerne uoppløselig CaSO4. Den vandige løsningen av hypofosforsyre er konsentrert under redusert trykk.Konsentrert baryta vann kan brukes i stedet for kalsiumhydroksyd.2. Ved behandling av natriumhypofosfitt, Nah2po2med en ionbytterharpiks.Natriumsaltet kan fremstilles ved å koke hvitt fosfor med en løsning av natriumhydroksid, en reaksjon som ligner på (1) ovenfor.
PH3 + 2I2 + 2H2O → H3PO2 + 4HI
ovennevnte metode kan betraktes som sikrere enn den som involverer oppvarming av hvitfosfor med alkali.
Hypofosforsyre må lagres under 50°C. det selges kommersielt som en vandig løsning i forskjellige konsentrasjoner.
Produksjonsmetoder
Hypofosforsyre dannes ved reaksjon av bariumhypofosfitt og svovelsyre, og filtrering av bariumsulfat. Ved fordampning av oppløsningen i vakuum ved 80 °C, og deretter avkjøling til 0°C, krystalliseres hypofosforsyre.
Definisjon
et hvitt krystallinsk fast stoff. Det er en monobasisk syre som danner anionen H2PO2-i vann. Natriumsaltet, og dermed syren, kan fremstilles ved oppvarming av gult fosfor med natriumhydroksydoppløsning. Den frie syren og dens salter er kraftige reduksjonsmidler.
Reaksjoner
Hypofosforsyre er blandbar med vann i alle proporsjoner og en kommersiell styrke er 30% H3PO2. Hypofosfitter brukes i medisin. Hypofosforsyre er et kraftig reduksjonsmiddel, f. eks. med kobbersulfat danner kobberhydrid Cu2H2, brunt bunnfall, som utvikler hydrogengass og etterlater kobber på oppvarming; med sølvnitrat gir finfordelt sølv; med svovelsyre gir svovel og noe hydrogensulfid; med svovelsyre gir svovelsyre, som reagerer som ovenfor; danner manganous umiddelbart med permanganate.
Generell Beskrivelse
Fargeløs oljeaktig væske eller deliquescent krystaller med sur lukt. Tetthet 1.439 g / cm3. Smeltepunkt 26.5°C. Innånding av damper irriterer eller brenner luftveiene. Væske og damp kan irritere eller brenne øyne og hud.
Luft & Vannreaksjoner
Deliquescent. Vannløselig.
Reaktivitetsprofil
HYPOFOSFORSYRE dekomponerer ved oppvarming til fosforsyre og spontant brannfarlig fosfin. Oksyderes av svovelsyre med frigjøring av svoveldioksid og svovel. Reagerer eksplosivt med kvikksølv (II) oksid . Reagerer voldsomt med kvikksølv (II) nitrat . Nøytraliserer baser i eksoterme reaksjoner.
Fare
Brann-og eksplosjonsfare ved kontakt med oksidasjonsmidler.
Helsefare
GIFTIG; innånding, svelging eller hudkontakt med materiale kan forårsake alvorlig skade eller død. Kontakt med smeltet stoff kan forårsake alvorlige brannskader på hud og øyne. Unngå hudkontakt. Effekter av kontakt eller innånding kan bli forsinket. Brann kan gi irriterende, etsende og/eller giftige gasser. Avrenning fra brannkontroll eller fortynningsvann kan være etsende og / eller giftig og forårsake forurensning.
Brannfare
ikke-brennbart stoff i seg selv brenner ikke, men kan brytes ned ved oppvarming for å produsere etsende og / eller giftige gasser. Noen er oksidasjonsmidler og kan antennes brennbare stoffer (tre, papir, olje, klær, etc.). Kontakt med metaller kan utvikle brannfarlig hydrogengass. Beholdere kan eksplodere ved oppvarming.
Rensemetoder
Fosforsyre Er en vanlig forurensning av kommersiell 50% hypofosforsyre. 600 ml i en 1l-kolbe ved 40o, under redusert trykk (I N2), til et volum på omtrent 300 ml. Etter at løsningen ble avkjølt, ble den overført Til en bredmunnet erlenmeyer-kolbe som ble stoppet og forlatt i Et tørris / acetonbad i flere timer for å fryse (om nødvendig, med riper på veggen). Når kolben ble deretter igjen ved ca 5o for 12timer, ca 30-40% av det flytende, og ble igjen filtrert. Denne prosessen ble gjentatt, da ble det faste stoffet lagret Over Mg (ClO4) 2 i en vakuumtørker i kulde. Etterfølgende krystalliseringer fra n-butanol ved å oppløse det ved romtemperatur og deretter avkjøle i et is-saltbad ved-20o syntes ikke å rense det ytterligere. Den frie syren danner deliquescent krystaller m 26.5 o og er løselig I H2O og EtOH. Nah2po2-saltet kan renses gjennom en anionbytterharpiks