Finegoldia magna jest ściśle beztlenowym gram-dodatnim koksem, który jest częścią komensalnej flory skóry, jamy ustnej, przewodu pokarmowego i żeńskiego układu moczowo-płciowego.1,2 opisujemy niezwykły przypadek skomplikowanego ropnia pośladkowego spowodowanego wyłącznie patogenem oportunistycznym u pacjenta z cukrzycą, który nie otrzymał wcześniej zastrzyków domięśniowych w dotkniętym obszarze.
60-letni mężczyzna przyszedł na oddział ratunkowy z intensywnym bólem i ropieniem lewego pośladka, które rozpoczęło się 2 tygodnie wcześniej. Przeszłość pacjenta obejmowała nadciśnienie tętnicze, dyslipidemię, nadwagę (wskaźnik masy ciała, 29), bielactwo, aktywne palenie (20 papierosów dziennie) i cukrzycę typu 2 trwającą 12 lat z dobrą kontrolą glikemii bez objawów powikłań metadiabetycznych (HbA1, 7%), chociaż zgłosił pogorszenie kontroli glikemii w domu w ostatnich tygodniach, zbiegające się z procesem zakaźnym. Pacjent nie zgłaszał żadnych wcześniejszych wstrzyknięć domięśniowych po pośladku. Leczono go kwasem acetylosalicylowym (100 mg/24 h), atorwastatyną (10 mg/24 h), glimepirydem (2 mg/24 h) i bisoprololem (5 mg/24 h).
badanie fizykalne wykazało duży, bolesny, gorący, wahliwy obrzęk na lewym pośladku, któremu towarzyszył szum i aktywne ropienie oraz obszar martwicy 10 cm (Fig. 1). Badania laboratoryjne wykazały następujące: hemoglobina, 15 g / dL; leukocyty; 10 870 mm3; płytki krwi, 121 000 mm3; czas protrombinowy, 16%; glukoza, 370 mg / dL; mocznik, 67 mg / dL; kreatynina, 1,25 mg / dL; kwas mlekowy 2 mmol / l; Prokalcytonina, 1,19 ng / mL; białko C-reaktywne, 249 mg / l.
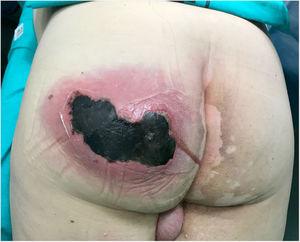
ropień na lewym pośladku z aktywnym ropieniem i dużym (10 cm) obszarem martwicy.
na podstawie wyników badań klinicznych pacjent przeszedł awaryjny drenaż na sali operacyjnej. Wyekstrahowano litr ropy, pobrano próbki do hodowli i przeprowadzono szerokie wycięcie tkanki martwiczej. W okresie pooperacyjnym pacjent wykazał korzystny przebieg kliniczny, odzyskując kontrolę glikemii oraz mobilność i funkcjonalność lewej nogi.
hodowle ropnia były ujemne dla bakterii tlenowych i dodatnie tylko dla ściśle beztlenowych Gram-dodatnich cocci, które typowanie bakteryjne zidentyfikowało jako F magna. Antybiogram F magna ujawnił wrażliwość na amoksycylinę-kwas klawulanowy, metronidazol i klindamycynę oraz Brak dowodów na oporność na antybiotyki. Pacjent został zwolniony ze szpitala i przepisane leczenie antybiotykami (metronidazol, 500 mg / 8 h) i ambulatoryjnej opieki chirurgicznej rany, na które zareagował dobrze.
F magna, wcześniej znany jako Peptostreptococcus magnus, przeszedł wiele zmian taksonomicznych, ponieważ został po raz pierwszy opisany w 1933 roku przez Prevota, który użył terminu Diplococcus magnus.3
f magna jest prawdopodobnie najczęstszą ze wszystkich Gram-dodatnich beztlenowych cocci (GPAC) i najbardziej patogenną postacią występującą w ludzkich próbkach klinicznych. Ten mikroorganizm jest częścią normalnej fauny i flory i występuje głównie w skórze, przewodzie pokarmowym, żeńskim układzie moczowo-płciowym i, w mniejszym stopniu, w jamie ustnej.1,2 W ostatnich latach zidentyfikowano 2 ważne białka, które wyjaśniają zjadliwość i zdolność kolonizacji f magna: białko adhezyjne powierzchniowe FAF (współczynnik adhezji f magna) i subtylizynopodobną proteazę serynową SufA.2,4 w górnych warstwach naskórka, FAF pośredniczy w adhezji poprzez wiązanie się z galektyną-7, markerem komórek keratynocytów. Po wniknięciu bakterii w głąb skóry i dotarciu do błony podstawnej, SufA rozkłada kolagen IV. w skórze właściwej FAF oddziałuje z kolagenem V i fibryliną, co prawdopodobnie wyjaśnia, w jaki sposób f magna może dotrzeć do najgłębszych warstw tkanki skórnej podczas infekcji.5
f magna jest jednym z gatunków najczęściej hodowanych z ropni skóry, tkanek miękkich, kości i stawów, zwykle w kulturach polimikrobiologicznych, aw rzadkich przypadkach w czystych kulturach.Opisano pooperacyjne zapalenie śródpiersia, zapalenie wsierdzia zastawki protezowej i martwicze zapalenie płuc wywołane przez F magna.6 zastosowanie antybiotyków o szerokim spektrum działania, które zmieniają mikrobiotę skóry, wprowadzenie obcych materiałów (zastawki protetyczne, stawy zastępcze, cewniki) i wzrost liczby pacjentów leczonych lekami immunosupresyjnymi sprzyjają tym infekcjom, tworząc optymalne środowisko dla tych oportunistycznych patogenów.
oporność na środki przeciwdrobnoustrojowe wśród bakterii beztlenowych wzrasta na całym świecie.7 Większość GPAC (>90%) jest wrażliwa na penicylinę, a wiele z nich jest również wrażliwych na inne antybiotyki β-laktamowe,7-10, ale wykazują zwiększoną oporność na inne antybiotyki, takie jak klindamycyna, metronidazol i fluorochinolony.8-10 wskaźników oporności na klindamycynę wśród GPAC wynosi od 7% do 20%, ale wzrasta u niektórych gatunków, w tym gatunków F magna i Peptoniphilus.Większość GPAC jest nadal wrażliwa na metronidazol, chociaż opisano niektóre oporne na metronidazol szczepy f magna i Parvimonas micra.9
niniejszy przypadek ilustruje, w jaki sposób komensalna bakteria F magna jest zdolna do wytworzenia zaawansowanej martwiczej infekcji i podkreśla znaczenie identyfikacji na poziomie gatunku i określenia wrażliwości przeciwbakteryjnej bakterii beztlenowych z reprezentatywnych próbek po wyizolowaniu w czystych kulturach.
konflikty interesów
autorzy oświadczają, że nie występują konflikty interesów.