- Hypophosphorsyre kemiske egenskaber,anvendelser,produktion
- oversigt
- kemiske egenskaber
- bruger
- toksicitet
- fareidentifikation
- fremstillingsmetode
- produktionsmetode
- beskrivelse
- beskrivelse
- kemiske egenskaber
- fysiske egenskaber
- bruger
- Definition
- præparat
- produktionsmetoder
- Definition
- reaktioner
- generel beskrivelse
- Luft & Vandreaktioner
- Reaktivitetsprofil
- fare
- sundhedsfare
- brandfare
- oprensningsmetoder
Hypophosphorsyre kemiske egenskaber,anvendelser,produktion
oversigt
Hypophosphorsyre er også kendt som “hypophosphit” det er farveløs olie eller delikatessekrystal , det er et vigtigt fint kemisk produkt. Den vigtigste anvendelse er som reduktionsmiddel til elektroløs plettering, phosphor forhindrer misfarvning af harpikser, det kan også bruges i esterificeringsreaktionskatalysatoren, kølemidlet, især til fremstilling af natriumhypophosphit med høj renhed. Der er flere metoder til fremstilling, den fælles industrielle metode til fremstilling er ionbytterharpiksmetode og elektrodialysemetode.
de kemiske egenskaber ved hypophosphorsyre, anvendelser, toksicitet og produktionsmetoder redigeres af andy fra Chemicalbook. (2016-12-04)
kemiske egenskaber
det er henflydende krystaller eller farveløs olie. Smeltepunkt: 26.5 liter. Den relative densitet (specifik tyngdekraft): 1.439 (fast, 19 liter). Det er opløseligt i vand, ethanol og ether, og det kan blandes i enhver andel med vand, ethanol, acetone. I luften er det let at sprede sig til sirupagtig væske, og den vandige opløsning er sur.
Hypophosphorsyre er monobasisk syre, i vandig opløsning, Hypophosphorsyre er stærk syre, Ka = 10-2 (25 liter); den er relativt stabil ved stuetemperatur; disproportioneringsreaktion kan fortsætte ved 130 liter, nedbrydes til phosphin og phosphorsyre:
2h3po2=H3PO4+PH3
den har stærk reduktion, tungmetalsaltopløsning kan gendannes til metaller såsom Cu2 +, Hg2 +, Ag +, sådan en opløsning as:
4AG+H3PO2+2H2)=4AG+H3PO4+4h+
det er svagt iltningsmiddel, det kan reduceres til phosphin, phosphin, når det møder stærkt reduktionsmiddel.
bruger
1. Hypophosphorsyre anvendes som reduktionsmiddel til elektroløs plettering;
2. Det kan bruges til at forhindre misfarvning af phosphorsyreharpiks;
3. Det anvendes som esterificeringskatalysator, kølemidlet;
4. Det bruges til at producere hypophosphit, natriumsalte, mangansalte, jernsalte anvendes generelt som nærende stoffer;
5. Hypophosphorsyre anvendes i medicin og som reduktionsmiddel, bestemmelse af arsen, tellurium og adskillelse af tantal, niob og andre reagenser.
6. Det er stærkt reduktionsmiddel, det kan bruges til fremstilling af natriumhypophosphit, calciumphosphat og anden hypophosphit.
7. Det kan bruges til pletteringsbadet. Lægemidler. reduktionsmiddel. generelle reagenser.
8. Det er stærkt reduktionsmiddel, det kan bruges til fremstilling af natriumhypophosphit, calciumphosphat og anden hypophosphit.
9. Dette produkt anvendes i vid udstrækning som reduktionsmiddel, Ag, Cu, Ni, Hg og andre metaller reduceres til det tilsvarende metal til verifikation af As, Nb, Ta og andre reagenser, det kan bruges til fremstilling af Na, K, Ca, Mn, Fe og andre typer hypophosphit.
toksicitet
det er ikke-brændbart. Men når kontakter med hullet h agent, vil det forårsage brand. Når mødes brandnærende middel, kan voldsom reaktion og forbrænding fortsætte. Når den opvarmes til høj, kan den nedbrydes til meget giftig fosfingas eller endda eksplodere. Det er ætsende. Hypophosphorsyre tilsættes ofte til læskedrikke, og fordi den ikke absorberes. Så risikoen er lille, men særlig stærk hypofosfit ondt gastrointestinal. Uheldigvis sprøjter det i øjnene eller kontakter huden, masser af vand bruges til at vaskes. Produktionsoperatører bør bære beskyttelsesbeklædning og andet beskyttelsesbeklædning. Produktionsudstyr skal forsegles, værkstedet skal ventileres godt.
fareidentifikation
faresætning:
forårsager alvorlige hudforbrændinger og øjenskader.
forårsager alvorlig øjenskade
sikkerhedssætninger:
Undgå indånding af støv/røg/gas/tåge/dampe/spray.
vask grundigt efter håndtering.
brug beskyttelseshandsker og beskyttelse af øjne/ansigt.
ved indtagelse: Skyl munden. Fremkald ikke opkastning.
ved kontakt med huden (eller håret): fjern/tag straks alt forurenet tøj af. Skyl huden med vand/bruser.
VED KONTAKT MED ØJNENE: Skyl forsigtigt med vand i flere minutter. Fjern kontaktlinser, hvis
er til stede og let at gøre. Fortsæt skylning.
ved indånding: fjern offeret i frisk luft og hold dig i ro i en position, der er behagelig til vejrtrækning.
ring straks til et giftcenter eller en læge.
butik låst op.
Bortskaf dette materiale og dets beholder til indsamlingsstedet for farligt eller specielt affald.
fremstillingsmetode
1. Bariumsalt Ba (H2PO2) 2 • 2H2O kan generere, svovlsyre tilsættes til hypophosphorsyre bariumopløsning, Ba2+ kan udfælde:
Ba(H2PO2)2+H2SO4=BaSO4+2h3po2
Hypophosphorsyre kan opnås ved fordampning under reduceret tryk og krystallisering ved lav temperatur. På grund af i denne proces er opløseligheden af bariumsaltet lille, så koncentrationen af opnået Hypophosphorsyre er ikke høj, industriprodukt skal renses ved omkrystallisation.
2. hvid fosfor opvarmes sammen for at danne sekundært bariumphosphat (eller calcium) og reagerer derefter med svovlsyre, det filtreres, koncentreres for at opnå produkt, eller natriumhypophosphitopløsning fortsætter h-type ionbytterharpiks kan udlede produkt. Denne metode kræver en stor mængde harpiks, og harpiksregenerering og vasketrin er besværligt, det koster generelt mere end $ 7 pr.
3. Hypophosphorsyre fremstilles ved elektrodialysemetode, hvor elektrodialysecellen opdeles i tre dele, de er anodekammer, råmaterialekammer og katodekammer, mellemproduktet adskilles af anionisk membran og kationisk membran, mellem to membraner placeres natriumhypophosphitopløsning (koncentration på 100 g/L~500 g/L), anodekammeret er fortyndet opløsning af Hypophosphorsyre 5g/L, anodekammeret er fortyndet natriumhydroksidopløsning ( 5g /L) mellem polerne DC (3V~36V) passeres, anode frigiver ilt og genererer sekundært produkt af hypophosphorsyre; reaktionstiden er 3~21h. reaktionerne fra anodekammer og katodekammer er som følger:
anodekammer:
H2O==H++OH-
2OH-==O2+2H2O+4e
H++H2PO2-==H3PO2
katodekammer:
H2O==H++Oh-
2H++2e==H2
na++Oh-==NaOH
elektrodialyse fremstillingsmetode hypofosforsyre er enkel og udstyr investering er lille, det er egnet til masseproduktion.
4. Startende fra den industrielle kvalitet natriumhypophosphit, Cl -, SO42-anioner, der påvirker kvalitetsindikatorerne for Hypofosforsyre, fjernes ved udfældning, tungmetalioner fjernes fra opløsningen ved dannelse af sulfid, og derefter ved anvendelse af stærk syrekationbytterharpiks til opnåelse af natrium sekundært fosfat, produkt af høj renhed kan opnå. Processen kan producere højkvalitets sekundært fosfat, teknisk er det muligt, processen er enkel, nem betjening, god produktkvalitet, den kan imødekomme behovene i elektronikindustrien, forsvarsindustrien og andre højteknologiske felter.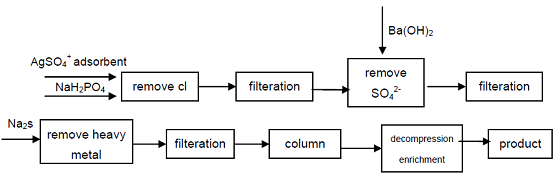
figur 1 produktionsproces af Hypophosphorsyre fra industriel Natriumhypophosphit.
5. 70 g kationbytterharpiks fugtet med vand pakkes i et glasrør med 5 mol/L saltsyre, der cirkulerer omkring 15 minutter, efter grundigt vasket med vand, vandig natriumhypophosphit vandig opløsning med høj renhed (15 g/60 ml H2O) strømmer gennem den, harpikssøjlen vaskes først med 50 ml og derefter med 25 RNL destilleret vand. Spildevandet syre og vask kombineres, er det koncentreret ved fordampning i vandbad. Den koncentrerede syre anbringes i højvakuum med P205 tørretumbler til dehydrering, afkøling og krystallisation, filtrering, omkrystallisation for at opnå hypofosforsyreprodukt.
produktionsmetode
Ionbytterharpiksmetode: læg ca.70 g vandopløselige kationbytterharpikser til at fylde i et glasrør. Cirkuler med 5 mol/L saltsyre i cirka 15 minutter og vask tilstrækkeligt med vand. Har en høj vandig natriumhypophosphitopløsning (15 g/60 ml H2O) til at strømme gennem harpikssøjlen efterfulgt af først at blive vasket med 50 ml vand og derefter skyllet med 25 RNL destilleret vand. Spildevandssyren og vaskningerne blev kombineret og koncentreret ved fordampning på et vandbad. Den koncentrerede syre sendes til højvakuum, P205 tørretumbler til dehydrering, efterfulgt af afkøling krystallisation, filtrering og omkrystallisation for at opnå det færdige produkt af hypophosphorsyre.
beskrivelse
Hypophosphorsyre er et kraftigt reduktionsmiddelmed en molekylformel af H3PO2. Uorganiske kemikerehenviser til den frie syre ved dette navn, selvom dens Iupacnavn er dihydridhydroksidooksidophosphor, eller det antagelige navn på phosphinsyre. Det er en farveløslavsmeltende forbindelse, som er opløselig i vand,dioksan og alkoholer. Formlen for hypofosforsyre er generelt skrevet H3PO2, men en mere beskrivende præsentation er HOP(O)H2 som fremhæverdens monoprotiske karakter. Salte afledt af denne syrekaldes phosphinater (hypophosphitter).
beskrivelse
denne syre har den generelle formel afh4p2o6 og adskiller sig fra de andre oksyphosphorsyrer. Det har mange peculiarities.It er dannet sammen med fosfor og fosforsyrer, når fosfor er iltet af fugtig luft.Hvis hvidt fosfor udsættes for luft, og natriumacetattilsættestil væskensom dannes, det noget uopløseligenatriumhypophosphat,Na2H2P2O6·6h2oseparerer. Natriumhypophosphatmonohydrat er imidlertid meget opløseligt og henflydende ved 98,7 g/100 ml.
kemiske egenskaber
farveløs væske
fysiske egenskaber
farveløse henflydende krystaller eller olieagtig væske; sur lugt; densitet 1,493 g/cm3;smelter ved 26,5 liter C; koger ved 130 liter C; meget opløselig i vand, alkohol og ether; den-sity af en 50% vandig opløsning er 1,13 g/mL.
bruger
fremstilling af hypofosfitter, galvaniseringbade.
Definition
ChEBI: et fosforoksocid, der består af en enkelt pentavalent fosfor, der er kovalent bundet via enkeltbindinger til to hydrogener og en hydroksigruppe og via en dobbeltbinding til et ilt. Forældrene til klassen af phosphinsyrer.
præparat
Hypophosphorsyre kan fremstilles ved forskellige metoder:
1. Kogende hvidt fosfor med calciumhydroksid:
P4 + 4CA(OH)2 + 8h2o-4CA(H2PO2)2 + 4H2
calciumsaltet er opløseligt i vand. Behandling med svovlsyre udbytterhypophosphorsyre:
(H2PO2) 2CA + H2SO4 liter 2H3PO2 + CaSO4
produktblandingen filtreres for at fjerne uopløselig CaSO4. Den vandige opløsning af hypofosforsyre koncentreres under reduceret tryk.Koncentreret baryta-vand kan anvendes i stedet for calciumhydroksid.2. Ved behandling af natriumhypophosphit, Nah2po2med en ionbytterharpiks.Natriumsaltet kan fremstilles ved kogning af hvidt fosfor med en opløsning af natriumhydroksid, en reaktion svarende til (1) ovenfor.
PH3 + 2I2 + 2H2O kur H3PO2 + 4HI
ovennævnte metode kan betragtes som sikrere end den, der involverer opvarmning af hvidphosphor med en alkali.
Hypophosphorsyre skal opbevares under 50 kg C. Den sælges kommercielt som en vandig opløsning i forskellige koncentrationer.
produktionsmetoder
Hypophosphorsyre dannes ved reaktion af bariumhypophosphit og svovlsyre og filtrering af bariumsulfat. Ved fordampning af opløsningen i vakuum ved 80 liter C og derefter afkøling til 0 liter C krystalliserer hypofosforsyre.
Definition
et hvidt krystallinsk fast stof. Det er en monobasisk syre, der danner anionen H2PO2-i vand. Natriumsaltet og dermed syren kan fremstilles ved opvarmning af gul fosfor med natriumhydroksidopløsning. Den frie syre og dens salte er kraftige reduktionsmidler.
reaktioner
Hypophosphorsyre er blandbar med vand i alle proportioner, og en kommerciel styrke er 30% H3PO2. Hypophosphitter anvendes i medicin. Hypofosforsyre er et kraftigt reduktionsmiddel, f.eks. med kobbersulfatformer cuprous hydrid Cu2H2, brunt bundfald, der udvikler brintgas og efterlader kobber ved opvarmning; med sølvnitrat giver fint opdelt sølv; med svovlsyre giver svovlsyre og noget hydrogensulfid; med svovlsyre giver svovlsyre, som reagerer som ovenfor; danner straks mangan med permanganat.
generel beskrivelse
farveløs olieagtig væske eller henflydende krystaller med en sur lugt. Tæthed 1,439 g / cm3. Smeltepunkt 26,5 kg C. indånding af dampe irriterer eller forbrænder luftvejene. Væske og dampe kan irritere eller brænde øjne og hud.
Luft & Vandreaktioner
Henflydende. Vandopløseligt.
Reaktivitetsprofil
HYPOPHOSPHORSYRE nedbrydes, når den opvarmes til phosphorsyre og spontant brandfarligt phosphin. Svovlsyre er en af de mest almindelige typer af svovlsyre. Reagerer eksplosivt med kviksølv(II). Reagerer voldsomt med kviksølv(II) nitrat . Neutraliserer baser i eksoterme reaktioner.
fare
risiko for Brand og eksplosion ved kontakt med brandnærende stoffer.
sundhedsfare
giftig; indånding, indtagelse eller hudkontakt med materiale kan forårsage alvorlig personskade eller død. Kontakt med smeltet stof kan forårsage alvorlige forbrændinger i hud og øjne. Undgå hudkontakt. Virkningerne af kontakt eller indånding kan blive forsinket. Brand kan producere irriterende, ætsende og / eller giftige gasser. Afstrømning fra brandbekæmpelse eller fortyndingsvand kan være ætsende og / eller giftigt og forårsage forurening.
brandfare
ikke-brændbart, stoffet selv brænder ikke, men kan nedbrydes ved opvarmning for at producere ætsende og/eller giftige dampe. Nogle er iltningsmidler og kan antænde brændbare stoffer (træ, papir, olie, tøj osv.). Kontakt med metaller kan udvikle brandfarlig brintgas. Beholdere kan eksplodere, når de opvarmes.
oprensningsmetoder
fosforsyre er en almindelig kontaminant af kommerciel 50% hypophosphorsyre. Jenkins og Jones rensede dette materiale ved at fordampe ca.600 ml i en 1L kolbe ved 40o under reduceret tryk (i N2) til et volumen på ca. 300 ml. Efter at opløsningen var afkølet, blev den overført til en Erlenmeyer-kolbe med bred mund, som blev stoppet og efterladt i et tøris/acetonebad i flere timer for at fryse (om nødvendigt med ridser af væggen). Da kolben derefter blev efterladt ved ca 5o i 12 timer, flydende omkring 30-40% af den og blev igen filtreret. Denne proces blev gentaget, hvorefter det faste stof blev opbevaret over Mg (ClO4) 2 i en vakuum-tørremiddel i kulden. Efterfølgende krystallisationer fra n-butanol ved opløsning ved stuetemperatur og derefter afkøling i et is-saltbad ved-20o syntes ikke at rense det yderligere. Den frie syre danner henflydende krystaller m 26,5 o og er opløselig i H2O og EtOH. NaH2PO2-saltet kan renses gennem en anionbytterharpiks