jeg læste en artikel for nylig, der lavede en off-hand henvisning til 100% ilt shunt fraktion test. Resultater fra testen blev inkluderet i dataanalysen, men de ligninger, forskerne brugte, blev ikke præsenteret, og de blev heller ikke henvist til, og proceduren blev heller ikke beskrevet. Dette skyldes sandsynligvis, at shuntfraktionstesten og dens ligninger er meget gammeldags lungefysiologi, men selvom emnet sandsynligvis er dækket på et eller andet tidspunkt i fysiologiklasser, formoder jeg, at nogle af de problemer, der er involveret i beregningen, ikke er så godt forstået som de burde være.
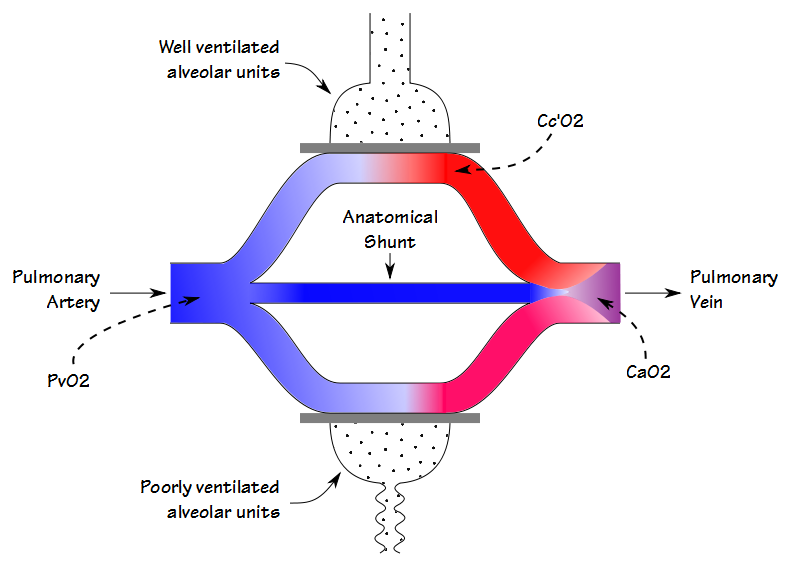
der er nogle ligheder mellem deadspace-tidevandsvolumenforholdet (Vd/Vt) og shuntfraktionen, men selvom de begge er involveret i gasudveksling (og til en vis grad korrelerer de også med hinanden), måler de forskellige ting. Når blod strømmer gennem lungen, passerer noget blod gennem godt ventilerede alveoler og bliver fuldt mættet; noget blod passerer gennem dårligt ventilerede alveoler og er kun delvist mættet; og nogle omgår alveolerne helt. Det resulterende arterielle iltindhold er det summerede gennemsnit af alle disse rum.
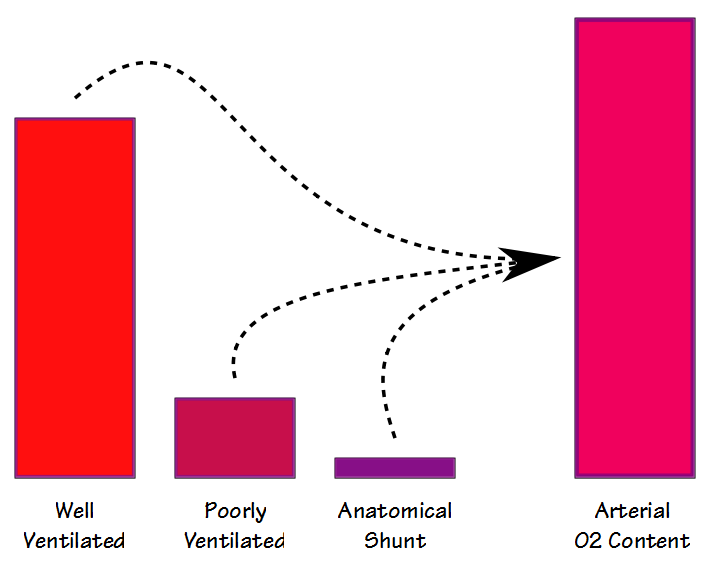
der er to forskellige måder, hvorpå shuntfraktion kan måles og beregnes; fysiologisk og anatomisk. Den fysiologiske shuntligning kan udføres ved enhver FiO2 (men normalt omkring FiO2 i rumluft) og kræver, at arterielle og blandede venøse blodprøver tages mere eller mindre samtidigt og derefter analyseres for PO2 og SaO2. Den grundlæggende formel er:
hvor:
KS = blodgennemstrømning gennem shunt
kt = Total blodgennemstrømning
Cc ‘ O2 = pulmonal kapillær O2 indhold
CaO2 = arterielt O2 indhold
CvO2 = blandet venøst O2 indhold
iltindhold er milliliter ilt pr. liter blod og beregnes ud fra:
hvor:
Hb = hæmoglobin (gram/decaliter)
SO2 = iltmætning (%)
PO2 = iltpartialtryk
det pulmonale kapillære O2-indhold kan ikke måles direkte (og strengt taget er det mere af en konceptuel værdi end en reel) og estimeres normalt ud fra den alveolære luftligning (skønt “ideelt” lungekapillærblod har en PO2-gradient på ca.1 mm).
hvor:
Pb = barometertryk i mm Hg
FiO2 = fraktioneret koncentration af inspireret ilt
PaCO2 = arterielt partialtryk af CO2
RER = respirationsudvekslingsforhold
iltindholdet i lungekapillærerne bestemmes ved først at estimere iltmætningen fra PAO2, og dette kan gøres enten visuelt fra iltindholdet i de pulmonale kapillærer dissociationskurve:
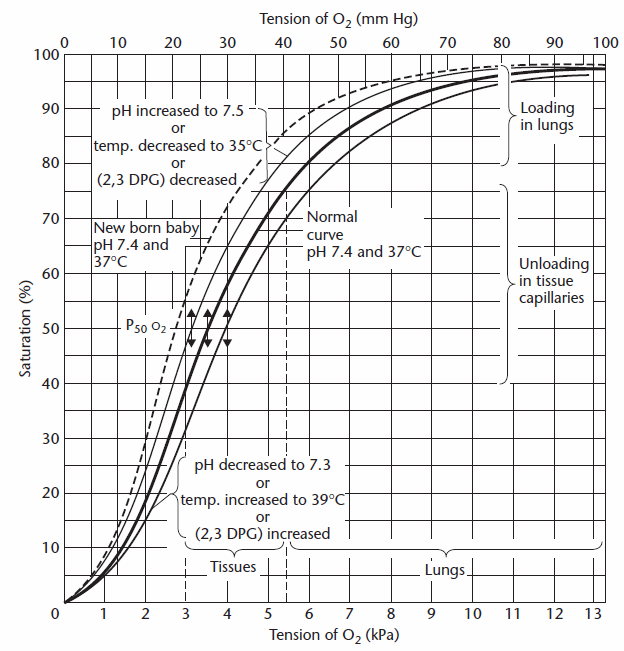
fra Cotes et al, pg. 260.
eller fra Severinghaus formel:
og derefter beregne Cc ‘ O2 i overensstemmelse hermed.
Bemærk: interessant nok tager hverken iltdissociationskurven eller Severinghaus ‘ formel hensyn til carboksyhemoglobin (eller methemoglobin). For den sags skyld er dette problem ikke medtaget i nogen af lærebogdiskussionerne om shunt-fraktion, jeg har læst. COHb skæver forholdet mellem PO2 og SO2 (nedad, hvis du arbejder fra PO2 til SO2, opad, hvis du arbejder fra SO2 til PO2). Normale COHb-niveauer hos ikke-rygere er 1-2, og denne mængde COHb vil sandsynligvis ikke gøre en signifikant forskel i shuntfraktionsberegningerne. I mangel af faste retningslinjer bør de dog, når højere niveauer af COHb er til stede, sandsynligvis anvendes til at justere Cc ‘ O2 i overensstemmelse hermed.
tager normale værdier og arbejder baglæns, PaO2 er:
den pulmonale kapillære iltmætning er derfor:
og det pulmonale kapillære iltindhold er:
blandet venøst blod har nominelt en PO2 på 40 og en iltmætning på 75%, så:
CaO2 beregnes derefter ud fra en persons faktiske PaO2 og SaO2. Afhængigt af de specifikke resultater vil shuntfraktionen være:
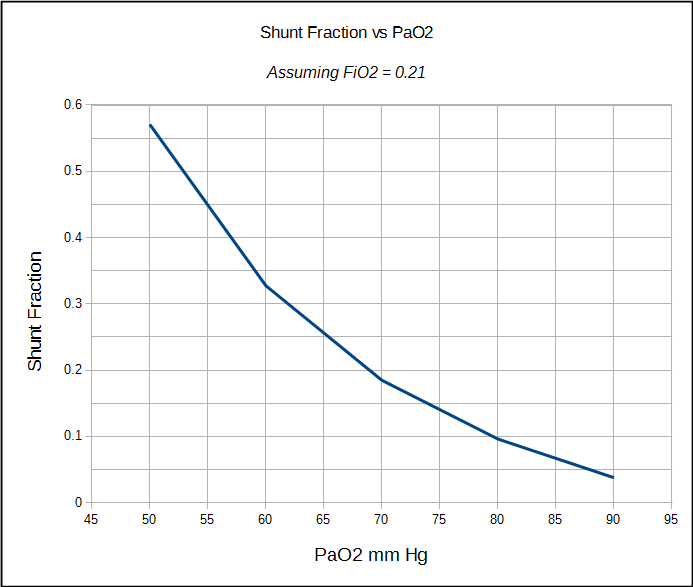
den fysiologiske shuntfraktion kan kun beregnes, når både arteriel og blandet venøs PO2 og SO2 er kendt. Af denne grund udføres det oftest i et hjertekatlaboratorium, operationsstue eller intensivafdeling, hvor indbyggede arterielle og centrale venøse linjer er relativt almindelige. Den fysiologiske shuntberegning kan imidlertid ikke skelne mellem rangeringen forårsaget af dårligt ventilerede alveolære enheder og den fra en anatomisk shunt. Den anatomiske shuntfraktion kan dog beregnes ved en separat procedure, og det er her 100% O2-testen kommer i spil.
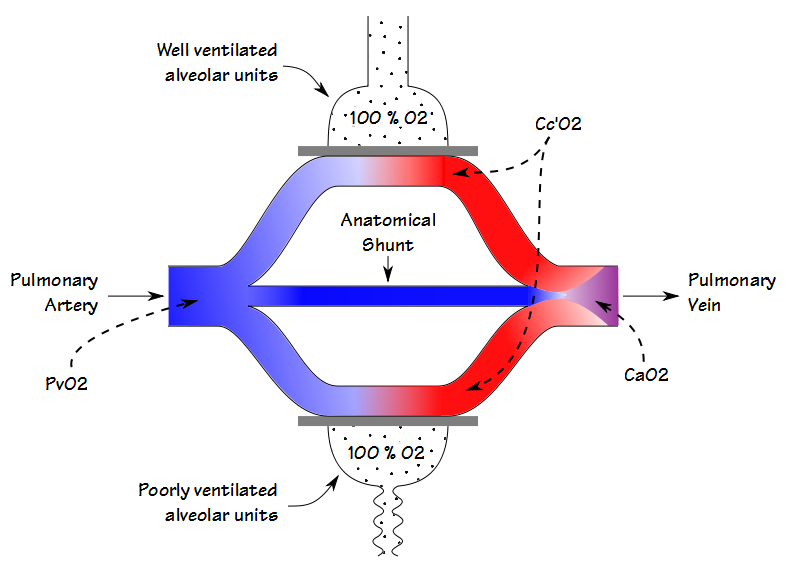
ved at have en patient ånde 100% O2, indtil nitrogenet er blevet vasket ud af deres lunge (nominelt 20 minutter), vil iltkoncentrationen i selv dårligt ventilerede enheder nærme sig 100%. Dette betyder, at partialtrykket og mætningen af blod, der forlader både de dårligt og de godt ventilerede alveolære enheder, vil være de samme. Af denne grund skyldes ethvert fald i det arterielle iltindhold udelukkende en anatomisk shunt.
hvis en patient har et indbygget centralt venekateter, kan beregningen af anatomisk shunt fortsætte på samme måde som allerede detaljeret. Hvis der kun kan opnås en arteriel prøve (hvilket normalt er tilfældet i et PFT-laboratorium), kan en arteriel-venøs O2-indholdsforskel på mellem 4,4 og 5,0 antages, og shuntfraktionen beregnes i overensstemmelse hermed.
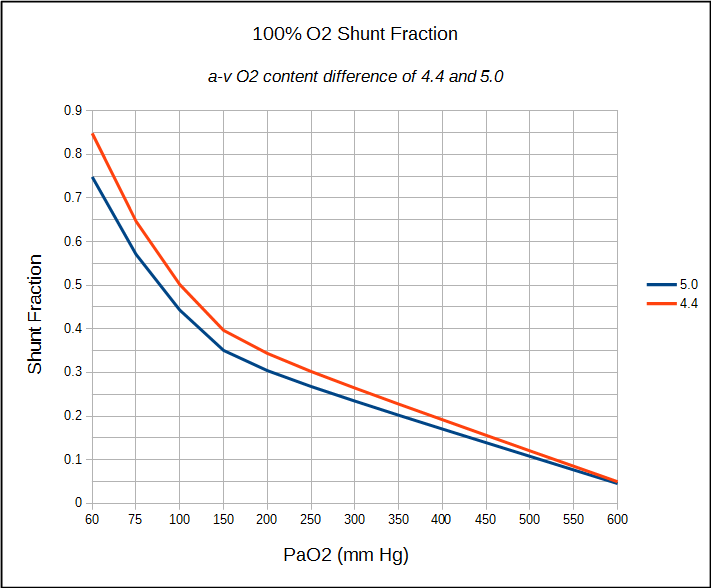
begrænsningerne i shuntfraktionsberegningerne skal delvis gøres med nogle af antagelserne om normale værdier og delvis med nøjagtigheden af blodgasmålinger. Den alveolære luftligning antager for eksempel, at åndedrætsudvekslingsrationen (RER) er 0,8, men den eneste måde at være sikker på er ved faktisk at måle VO2 og VCO2. Strengt taget vil en RER, der er anderledes end 0.8, sandsynligvis ikke gøre en væsentlig forskel i beregnet PAO2, Sc ‘O2 og Cc’ O2, men det er stadig en antagelse. Brug af en A-v O2-indholdsforskel på 4,4 til 5,0 på den anden side er en meget større antagelse. Det er til en vis grad berettiget af det faktum, at 100% O2-testen normalt foretages i hvile, og dette er rimelige værdier for en person i hvile, men igen er det en antagelse.
langt mere om er begrænsningerne i nøjagtig måling af PaO2 og SaO2, især ved højere FiO2 ‘ er. to forskellige undersøgelser har vist, at den type sprøjte, der blev brugt til at opnå en ABG (glas versus plast), og hvordan den blev opbevaret (på is eller ved stuetemperatur) gjorde en signifikant forskel i den beregnede shuntfraktion, selv når ABG-prøverne blev analyseret hurtigt. Når der var længere ventetid før analysen, kunne fejlen i PaO2 medføre, at den beregnede shuntfraktion var dobbelt så stor som den virkelig var. Årsagen til, at dette sker, skyldes dels diffusion gennem plastiksprøjterne og delvis til fortsat metabolisme i en blodprøve, når den holdes ved stuetemperatur. Den mindste ændring blev set, når glassprøjter blev holdt på is.
interessant nok viste en lignende undersøgelse med ABG-prøver taget ved normal FiO2 (PO2-oprensning 100) den modsatte virkning. Den målte PO2 havde tendens til at stige, igen mere i plastiksprøjter end i glas, og igen dette sandsynligvis på grund af diffusion. Interessant nok faldt PO2 i glassprøjter, der blev holdt på is, og forfatterne, viden et al., påpeger, at opløseligheden af O2 stiger, når temperaturen falder, og at med mere O2 i opløsning kan PO2 falde.
endelig kalibreres blodgasanalysatorer normalt ved hjælp af gaskoncentrationer i det normale fysiologiske område. Enhver arteriel blodprøve med PO2 over 200 mm Hg ligger godt uden for dette interval, og jeg er bekymret for, hvilken slags fejlbjælke der er for PO2 ‘ er, der er endnu højere. Pretto et al brugt blod tonometered med 95% O2 og 5% CO2, men interessant rapporterede de ikke den målte PO2, men kun ændringen i PO2 over tid. Opnåede blodprøver fra personer, der gennemgik 100% ilttest som en præ-op-vurdering for koronar bypass-operation, og den gennemsnitlige PO2 af deres guldstandardprøver (glassprøjte, iced, 5 minutters forsinkelse) var 590 mm Hg. Dette er en a-a gradient på omkring 80 mm Hg og kan meget vel være passende, men det betyder også, at den gennemsnitlige anatomiske shuntfraktion var 10%, og Cotes et al indikerer, at den normale anatomiske shunt for individer i samme aldersgruppe er omkring 4%.
shuntfraktionstesten udføres ikke almindeligt i lungefunktionslaboratorier. Ægte anatomiske shunts er relativt sjældne, og den mest passende patient til 100% O2 shuntfraktionstesten ville være en med en reduceret SaO2 i hvile, der ikke forbedres signifikant med supplerende O2.
den fysiologiske shuntfraktion kunne betragtes som bagsiden af Vd/Vt. Perfusion inhomogeniteter eksisterer lige så meget som ventilationsinhomogeniteter, men dette kan overses, fordi lungefunktionstest er orienteret langt mere omkring ventilationssiden af respiration end perfusionssiden. Ventilation og perfusion inhomogeniteter er centrale træk ved mange lungesygdomme. Af denne grund skal shuntfraktionen og forskellene mellem dens fysiologiske og anatomiske komponenter være en del af uddannelsen af alle lungeteknologer. Ligesom Vd / Vt er der dog også begrænsninger for nøjagtigheden af shuntfraktionsberegningen både fra antagelser, der måske eller måske ikke er rimelige, og fra målenøjagtigheden af PO2 og SO2.
Aboab J, Louis B, Jonson B, Brochard L. forholdet mellem PaO2/FiO2 og FiO2: en matematisk beskrivelse. Kapitel i Anvendt Fysiologi i Intensivmedicin, Pinsky MR, Brochard L, Mancebo JM redaktører. Springer – Verlag Heidelberg, 2006.
Conrad SA, Georg RB. Lungefunktionstest. Principper og praksis. Churchill Livingston Publishing, 1984.
Cotes JE, Chinn DJ, Miller Mr. lungefunktion, 6.udgave. Forlagsvirksomhed, 2006.
kender TP, Mullin RA, Hunter JA, Douce FH. Virkninger af sprøjtemateriale, prøvelagringstid og temperatur på blodgasser og iltmætning i arterielle humane blodprøver. Respir Pleje 2006; 51(7): 732-736.
Pretto JJ, Rochford PD. Virkninger af prøvelagringstid, temperatur og sprøjtetype på spændinger i blodgas i prøver med højt ilttryk. Brystkasse 1994; 49: 610-612.
Smeenk JJM, Janssen JDJ, Arends BJ, Harff GA, van Den Bosch JA, Schonberger JPAM, POSTMUS PE. Effekter af fire forskellige metoder på prøveudtagning af arterielt blod og opbevaringstid på gasspændinger og shunt-beregning i 100% ilttest. EUR Respir J 1997; 10: 910-913.

PFT Blog af Richard Johnston er licenseret under en Creative Commons Attribution-NonCommercial 4.0 International licens