Finegoldia magna est un coccus gram positif strictement anaérobie qui fait partie de la flore commensale de la peau, de la cavité buccale, du tractus gastro-intestinal et du tractus urogénital féminin.1,2 Nous décrivons un cas inhabituel d’abcès fessier compliqué causé exclusivement par un agent pathogène opportuniste chez un patient atteint de diabète sucré qui n’avait pas reçu d’injections intramusculaires antérieures dans la zone touchée.
Un homme de 60 ans s’est présenté aux urgences avec une douleur intense et une suppuration à la fesse gauche qui avait commencé 2 semaines plus tôt. Les antécédents du patient comprenaient l’hypertension, la dyslipidémie, le surpoids (indice de masse corporelle, 29), le vitiligo, le tabagisme actif (20 cigarettes par jour) et le diabète sucré de type 2 d’une durée de 12 ans avec un bon contrôle glycémique sans preuve de complications métadiabétiques (HbA1,7%), bien qu’il ait signalé une aggravation du contrôle glycémique à la maison au cours des dernières semaines, coïncidant avec le processus infectieux. Le patient n’a rapporté aucune injection intramusculaire fessière antérieure. Il était traité avec de l’acide acétylsalicylique (100 mg / 24 h), de l’atorvastatine (10 mg / 24 h), du glimépiride (2 mg / 24 h) et du bisoprolol (5 mg / 24 h).
L’examen physique a révélé un gonflement important, douloureux, chaud et fluctuant sur la fesse gauche accompagné de crépitus et de suppuration active, et une zone nécrotique de 10 cm (Fig. 1). Les tests de laboratoire ont révélé ce qui suit: hémoglobine, 15 g / dL; leucocytes; 10 870 mm3; plaquettes, 121 000 mm3; temps de prothrombine, 16%; glucose, 370 mg / dL; urée, 67 mg / dL; créatinine, 1,25 mg / dL; acide lactique 2 mmol /L; procalcitonine, 1,19 ng / mL; Protéine C-réactive, 249 mg /L.
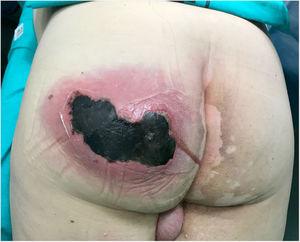
Abcès sur la fesse gauche avec suppuration active et grande zone de nécrose (10 cm).
Sur la base des résultats cliniques, le patient a subi un drainage d’urgence dans la salle d’opération. Un litre de pus a été extrait, des échantillons ont été prélevés pour la culture et une large excision du tissu nécrotique a été réalisée. Pendant la période postopératoire, le patient a montré une évolution clinique favorable, récupérant le contrôle glycémique et la mobilité et la fonctionnalité de la jambe gauche.
Les cultures d’abcès étaient négatives pour les bactéries aérobies et positives uniquement pour les cocci gram-positifs strictement anaérobies, que le typage bactérien identifiait comme F magna. Un antibiogramme pour F magna a révélé une sensibilité à l’amoxicilline-acide clavulanique, au métronidazole et à la clindamycine, et aucune preuve de résistance aux antibiotiques. Le patient est sorti de l’hôpital et a reçu un traitement antibiotique (métronidazole, 500 mg / 8 h) et des soins chirurgicaux ambulatoires des plaies, auxquels il a bien répondu.
F magna, précédemment connu sous le nom de Peptostreptococcus magnus, a subi de multiples changements taxonomiques depuis sa première description en 1933 par Prevot, qui a utilisé le terme Diplococcus magnus.3
Le F magna est probablement le plus commun de tous les cocci anaérobies à gram positif (GPAC) et la forme la plus pathogène trouvée dans les échantillons cliniques humains. Ce microorganisme fait partie du biote normal et se trouve principalement dans la peau, le tractus gastro-intestinal, le tractus génito-urinaire féminin et, dans une moindre mesure, la cavité buccale.1,2 Ces dernières années, 2 protéines importantes ont été identifiées qui expliquent la virulence et la capacité de colonisation de F magna: la protéine d’adhésion de surface FAF (facteur d’adhésion de F magna) et la sérine protéase de type subtilisine SufA.2,4 Dans les couches supérieures de l’épiderme, le FAF médie l’adhésion en se liant à la galectine-7, un marqueur cellulaire des kératinocytes. Une fois que les bactéries pénètrent plus profondément dans la peau et atteignent la membrane basale, le SufA décompose le collagène IV. Dans le derme, le FAF interagit avec le collagène V et la fibrilline, ce qui explique probablement comment le F magna peut atteindre les couches les plus profondes du tissu cutané pendant l’infection.5
F magna est l’une des espèces les plus couramment cultivées à partir d’abcès de la peau, des tissus mous, des os et des articulations, généralement dans des cultures polymicrobiennes et, dans de rares cas, dans des cultures pures.3 Une médiastinite postopératoire, une endocardite valvulaire prothétique et une pneumonie nécrosante due à F magna ont été décrites.6 L’utilisation d’antibiotiques à large spectre qui altèrent le microbiote cutané, l’introduction de matières étrangères (valves prothétiques, articulations de remplacement, cathéters) et l’augmentation du nombre de patients traités par des médicaments immunosuppresseurs favorisent ces infections en créant un environnement optimal pour ces pathogènes opportunistes.
La résistance aux antimicrobiens chez les bactéries anaérobies augmente dans le monde entier.7 La plupart des GPAC (> 90%) sont sensibles à la pénicilline, et beaucoup sont également sensibles à d’autres antibiotiques β-lactames, 7-10 mais présentent une résistance croissante à d’autres antibiotiques tels que la clindamycine, le métronidazole et les fluoroquinolones.8-10 Les taux de résistance à la clindamycine chez les GPAC varient de 7 % à 20 %, mais augmentent chez certaines espèces, y compris les espèces F magna et Peptoniphilus.7 La plupart des GPAC sont encore sensibles au métronidazole, bien que certaines souches résistantes au métronidazole de F magna et Parvimonas micra aient été décrites.9
Le présent cas illustre comment la bactérie commensale F magna est capable de produire une infection nécrosante avancée, et souligne l’importance de l’identification au niveau de l’espèce et de la détermination de la sensibilité antimicrobienne des bactéries anaérobies à partir d’échantillons représentatifs lorsqu’elles sont isolées dans des cultures pures.
Conflits d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts.