- Propriétés chimiques de l’acide hypophosphoreux, utilisations, production
- Contour
- Propriétés chimiques
- Utilisations
- Toxicité
- IDENTIFICATION DES DANGERS
- Méthode de préparation
- Méthode de production
- Description
- Description
- Propriétés chimiques
- Propriétés physiques
- Utilise
- Définition
- Préparation
- Méthodes de production
- Définition
- Réactions
- Description générale
- Réactions de l’air & De l’eau
- Profil de réactivité
- Danger
- Danger pour la santé
- Risque d’incendie
- Méthodes de purification
Propriétés chimiques de l’acide hypophosphoreux, utilisations, production
Contour
L’acide hypophosphoreux est également connu sous le nom de « hypophosphite » C’est une huile incolore ou un cristal de déliquescence, c’est un produit chimique fin important. L’utilisation principale est comme agent réducteur pour le placage sans électrolyte, le phosphore empêche la décoloration des résines, il peut également être utilisé dans le catalyseur de réaction d’estérification, le réfrigérant, en particulier pour la production d’hypophosphite de sodium de produit de haute pureté. Il existe plusieurs méthodes de préparation, la méthode industrielle commune de production est la méthode de résine échangeuse d’ions et la méthode d’électrodialyse.
Les propriétés chimiques de l’acide hypophosphoreux, les utilisations, la toxicité et les méthodes de production sont éditées par andy de Chemicalbook. (2016-12-04)
Propriétés chimiques
Ce sont des cristaux déliquescents ou de l’huile incolore. Point de fusion: 26,5 ℃. La densité relative (densité) : 1,439 (solide, 19℃). Il est soluble dans l’eau, l’éthanol et l’éther, et il peut être mélangé dans n’importe quelle proportion avec de l’eau, de l’éthanol, de l’acétone. Dans l’air, il se déliquète facilement en liquide sirupeux et la solution aqueuse est acide.
L’acide hypophosphoreux est un acide monobasique, en solution aqueuse, l’acide hypophosphoreux est un acide fort, Ka = 10-2 (25 ℃); il est relativement stable à température ambiante; la réaction de disproportion peut se poursuivre à 130 ℃, se décomposer en phosphine et en acide phosphoreux:
2H3PO2 = H3PO4 + PH3
Il a une forte réduction, une solution de sel de métaux lourds peut être restaurée en métaux tels que Cu2 +, Hg2 +, Ag +, tels que:
4Ag + H3PO2 + 2H2) = 4Ag + H3PO4 + 4H +
C’est un oxydant faible, il peut être réduit en phosphine, phosphine lorsqu’il rencontre un agent réducteur fort.
Utilisations
1. L’acide hypophosphoreux est utilisé comme agent réducteur pour le placage électrolytique;
2. Il peut être utilisé pour prévenir la décoloration de la résine d’acide phosphorique;
3. Il est utilisé comme catalyseur d’estérification, le réfrigérant;
4. Il est utilisé pour produire de l’hypophosphite, les sels de sodium, les sels de manganèse, les sels de fer sont généralement utilisés comme substances nourrissantes;
5. L’acide hypophosphoreux est utilisé en médecine et comme agent réducteur, pour la détermination de l’arsenic, du tellure et la séparation du tantale, du niobium et d’autres réactifs.
6. C’est un agent réducteur fort, il peut être utilisé pour la préparation d’hypophosphite de sodium, de phosphate de calcium et d’autres hypophosphites.
7. Il peut être utilisé pour le bain de placage. Pharmaceutique. agent réducteur. réactifs généraux.
8. C’est un agent réducteur fort, il peut être utilisé dans la fabrication d’hypophosphite de sodium, de phosphate de calcium et d’autres hypophosphites.
9. Ce produit est largement utilisé comme agent réducteur, Ag, Cu, Ni, Hg et d’autres métaux sont réduits au métal correspondant, pour la vérification de l’As, du Nb, du Ta et d’autres réactifs, il peut être utilisé pour la préparation de Na, K, Ca, Mn, Fe et d’autres types d’hypophosphite.
Toxicité
Il est incombustible. Mais en cas de contact avec l’agent H du trou, cela provoquera un incendie. Lorsqu’il rencontre un agent oxydant, une réaction violente et une combustion peuvent se produire. Lorsqu’il est chauffé à haute température, il peut se décomposer en gaz phosphine hautement toxique, voire exploser. C’est corrosif. L’acide hypophosphoreux est souvent ajouté dans les boissons gazeuses, et parce qu’il n’est pas absorbé. Le risque est donc faible, mais l’hypophosphite particulièrement forte fait mal gastro-intestinal. Accidentellement, il éclabousse les yeux ou entre en contact avec la peau, beaucoup d’eau est utilisée pour se laver. Les opérateurs de production doivent porter des vêtements de protection et d’autres vêtements de protection. L’équipement de production doit être scellé, l’atelier doit être bien ventilé.
IDENTIFICATION DES DANGERS
Mention de danger :
Provoque de graves brûlures cutanées et des lésions oculaires.
Provoque de graves lésions oculaires
Conseils de prudence:
Ne pas respirer les poussières/ fumées/ gaz/ brouillards/ vapeurs/ aérosols.
Laver soigneusement après manipulation.
Porter des gants de protection et une protection des yeux/ du visage.
EN CAS D’INGESTION : Rincer la bouche. NE PAS faire vomir.
EN CAS DE CONTACT AVEC LA PEAU (ou les cheveux) : Enlever/Enlever immédiatement tous les vêtements contaminés. Rincer la peau à l’eau / douche.
EN CAS DE CONTACT AVEC LES YEUX : Rincer prudemment à l’eau pendant plusieurs minutes. Retirez les lentilles de contact, si
présentes et faciles à faire. Continuez à rincer.
EN CAS d’INHALATION : Amener la victime à l’air frais et la maintenir au repos dans une position confortable pour respirer.
Appelez immédiatement un CENTRE ANTIPOISON ou un médecin/ médecin.
Magasin fermé à clé.
Jetez ce matériau et son contenant au point de collecte des déchets dangereux ou spéciaux.
Méthode de préparation
1. Une solution d’hydroxyde de phosphore et de baryum est chauffée, le sel de baryum Ba (H2PO2) 2 • 2H2O peut générer, de l’acide sulfurique est ajouté à une solution de baryum d’acide hypophosphoreux, Ba2 + peut précipiter:
Ba (H2PO2) 2 + H2SO4 = BaSO4 + 2H3PO2
L’acide hypophosphoreux peut être obtenu par évaporation sous pression réduite et cristallisation à basse température. En raison de ce processus, la solubilité du sel de baryum est faible, de sorte que la concentration d’acide hypophosphoreux obtenu n’est pas élevée, le produit industriel doit être purifié par recristallisation.
2. l’oxyde de baryum (ou chaux) et la solution de phosphore blanc sont chauffés ensemble pour former du phosphate de baryum secondaire (ou calcium), puis réagissent avec de l’acide sulfurique, ils sont filtrés, concentrés pour obtenir un produit, ou une solution d’hypophosphite de sodium produit une résine échangeuse d’ions de type H peut dériver un produit. Cette méthode nécessite une grande quantité de résine, et l’étape de régénération et de lavage de la résine est lourde, elle coûte généralement plus de 7 dollars la livre, elle ne convient qu’à la production en petits lots et ne convient pas aux applications industrielles à grande échelle.
3. L’acide hypophosphoreux est préparé par procédé d’électrodialyse, dans lequel la cellule d’électrodialyse se divise en trois parties, elles sont une chambre anodique, une chambre de matière première et une chambre cathodique, l’intermédiaire est séparé par une membrane anionique et une membrane cationique, entre deux membranes une solution d’hypophosphite de sodium est placée (concentration de 100g / L ~ 500g / L), la chambre anodique est une solution diluée d’acide hypophosphoreux 5g / L, la chambre anodique est une solution diluée d’hydroxyde de sodium (5g / L), entre les pôles DC (3V ~ 36V) est passé, l’anode libère de l’oxygène et génère un produit secondaire d’acide hypophosphoreux; la cathode émet de l’hydrogène et génère un produit secondaire d’hydroxyde de sodium, le temps de réaction est de 3 ~ 21h. Les réactions de la chambre anodique et de la chambre cathodique sont les suivantes:
chambre anodique:
H2O == H ++ OH-
2OH- == O2 + 2H2O + 4e
H ++ H2PO2- == H3PO2
chambre cathodique:
H2O == H ++ OH –
2H ++2e == H2
Na ++ OH – == NaOH
La méthode d’électrodialyse de préparation de l’acide hypophosphoreux est simple et l’investissement en équipement est faible, il convient à la production de masse.
4. À partir de l’hypophosphite de sodium de qualité industrielle, les anions Cl-, SO42 qui affectent les indicateurs de qualité de l’acide hypophosphoreux sont éliminés par précipitation, les ions de métaux lourds sont éliminés de la solution en formant du sulfure, puis en utilisant une résine échangeuse de cations acides forts pour obtenir du phosphate secondaire de sodium, un produit de haute pureté peut obtenir. Le processus peut produire du phosphate secondaire de haute qualité, techniquement réalisable, le processus est simple, facile à utiliser, de bonne qualité du produit, il peut répondre aux besoins de l’industrie électronique, de l’industrie de la défense et d’autres domaines de haute technologie.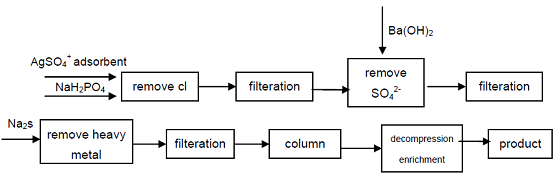
figure 1 Procédé de Production d’acide Hypophosphoreux à partir d’Hypophosphite de Sodium Industriel.
5. Méthode de résine échangeuse d’ions: environ 70 g de résine échangeuse de cations mouillée avec de l’eau sont emballés dans un tube de verre contenant de l’acide chlorhydrique à 5 mol / L circulant environ 15 min, après lavage à fond avec de l’eau, une solution aqueuse aqueuse d’hypophosphite de sodium de haute pureté (15 g / 60 ml de H2O) le traverse, la colonne de résine est d’abord lavée avec 50 ml, puis avec de l’eau distillée à 25 rnl. L’effluent acide et le lavage sont combinés, il est concentré par évaporation au bain-marie. L’acide concentré est placé sous vide poussé avec un sécheur P205 pour la déshydratation, le refroidissement et la cristallisation, la filtration, la recristallisation, pour obtenir un produit acide hypophosphoreux.
Méthode de production
Méthode de résine échangeuse d’ions: mettre environ 70 g de résines échangeuses de cations solubles dans l’eau à remplir dans un tube de verre. Circuler avec 5 moles/L d’acide chlorhydrique pendant environ 15 min et laver suffisamment à l’eau. Avoir une solution d’hypophosphite de sodium à haute teneur aqueuse (15 g / 60 ml d’H2O) pour traverser la colonne de résine, puis être lavée d’abord avec 50 ml d’eau, puis rincée avec de l’eau distillée à 25 rnl. L’acide effluent et les lavages ont été combinés et concentrés par évaporation au bain-marie. L’acide concentré est envoyé au séchoir P205 sous vide pour déshydratation, suivi d’une cristallisation par refroidissement, d’une filtration et d’une recristallisation pour obtenir le produit fini d’acide hypophosphoreux.
Description
L’acide hypophosphoreux est un puissant agent réducteuravec une formule moléculaire de H3PO2. Les chimistes inorganiques se réfèrent à l’acide libre par ce nom bien que son nom IUPAC soit dihydridohydroxidooxidophosphore, ou le nom acceptable de l’acide phosphinique. C’est un composé incolore à fusion lente, soluble dans l’eau, le dioxane et les alcools. La formule de l’acide hypophosphoreux s’écrit généralement H3PO2, mais une présentation plus descriptive est HOP(O)H2 qui met en évidence son caractère monoprotique. Sels dérivés de cet acidesont appelés phosphinates (hypophosphites).
Description
Cet acide a la formule générale de H4p2o6 et diffère des autres acides oxy-phosphoreux. Il a beaucoup peculiarities.It est formé avec le phosphore et le phosphoriqueacides, lorsque le phosphore est oxydé par l’air humide.Si le phosphore blanc est exposé à l’air et que l’acétate de sodique est ajouté au liquidequi se forme, l’hypophosphate de sodium quelque peu insoluble, Na2H2P2O6 · 6h2oséparés. L’hypophosphate de sodium monohydraté est cependant très soluble et déliquescent à ~98,7 g / 100 ml.
Propriétés chimiques
liquide incolore
Propriétés physiques
Cristaux déliquescents incolores ou liquide huileux; odeur aigre; densité 1,493 g / cm3; fond à 26,5 ° C; bout à 130 ° C; très soluble dans l’eau, l’alcool et l’éther; la densité d’une solution aqueuse à 50% est de 1,13 g/mL.
Utilise
Préparation d’hypophosphites, bains de galvanoplastie.
Définition
ChEBI: oxoacide de phosphore constitué d’un phosphore pentavalent unique lié de manière covalente via des liaisons simples à deux hydrogènes et un groupe hydroxy et via une double liaison à un oxygène. Le parent de la classe des acides phosphiniques.
Préparation
L’acide hypophosphoreux peut être préparé par différentes méthodes :
1. Faire bouillir du phosphore blanc avec de l’hydroxyde de calcium:
P4 + 4Ca (OH) 2 + 8H2O → 4Ca (H2PO2) 2 + 4H2
Le sel de calcium est soluble dans l’eau. Le traitement à l’acide sulfurique donne l’acide hypophosphoreux:
(H2PO2) 2Ca + H2SO4 → 2H3PO2 + CaSO4
Le mélange de produit est filtré pour éliminer le CaSO4 insoluble. La solution aqueuse d’acide hypophosphoreux est concentrée sous pression réduite.L’eau de baryte concentrée peut être utilisée à la place de l’hydroxyde de calcium.2. En traitant l’hypophosphite de sodium, NaH2PO2avec une résine échangeuse d’ions.Le sel de sodium peut être produit en faisant bouillir du phosphore blanc avec une solution d’hydroxyde de sodium, une réaction similaire à (1) ci-dessus.
PH3 + 2I2 + 2H2O → H3PO2 + 4HI
La méthode ci-dessus peut être considérée comme plus sûre que celle impliquant le chauffage du phosphore blanc avec un alcali.
L’acide hypophosphoreux doit être conservé à une température inférieure à 50 °C. Il est vendu commercialement en solution aqueuse à différentes concentrations.
Méthodes de production
L’acide hypophosphoreux est formé par réaction de l’hypophosphite de baryum et de l’acide sulfurique, et par filtration du sulfate de baryum. Par évaporation de la solution sous vide à 80 °C, puis refroidissement à 0 °C, l’acide hypophosphoreux cristallise.
Définition
Un solide cristallin blanc. C’est un acide monobasique formant l’anion H2PO2– dans l’eau. Le sel de sodium, et donc l’acide, peut être préparé en chauffant du phosphore jaune avec une solution d’hydroxyde de sodium. L’acide libre et ses sels sont de puissants agents réducteurs.
Réactions
L’acide hypophosphoreux est miscible avec l’eau en toutes proportions et sa force commerciale est de 30% H3PO2. Les hypophosphites sont utilisés en médecine. L’acide hypophosphoreux est un puissant agent réducteur, par exemple, avec le sulfate de cuivre forme de l’hydrure cuivreux Cu2H2, un précipité brun, qui fait évoluer l’hydrogène gazeux et laisse le cuivre au réchauffement; avec le nitrate d’argent donne de l’argent finement divisé; avec l’acide sulfureux donne du soufre et un peu de sulfure d’hydrogène; avec l’acide sulfurique donne de l’acide sulfureux, qui réagit comme ci-dessus; forme immédiatement manganeuse avec le permanganate.
Description générale
Liquide huileux incolore ou cristaux déliquescents à odeur aigre. Densité 1,439 g / cm3. Point de fusion 26,5 ° C. L’inhalation de vapeurs irrite ou brûle les voies respiratoires. Le liquide et les vapeurs peuvent irriter ou brûler les yeux et la peau.
Réactions de l’air & De l’eau
Déliquescentes. Soluble dans l’eau.
Profil de réactivité
L’ACIDE HYPOPHOSPHOREUX se décompose lorsqu’il est chauffé en acide phosphorique et en phosphine spontanément inflammable. Est oxydé par l’acide sulfurique avec libération de dioxyde de soufre et de soufre. Réagit de manière explosive avec l’oxyde de mercure (II). Réagit violemment avec le nitrate de mercure (II). Neutralise les bases dans les réactions exothermiques.
Danger
Risque d’incendie et d’explosion en contact avec des agents oxydants.
Danger pour la santé
TOXIQUE; l’inhalation, l’ingestion ou le contact cutané avec du matériel peuvent causer des blessures graves ou la mort. Le contact avec une substance fondue peut causer de graves brûlures à la peau et aux yeux. Évitez tout contact avec la peau. Les effets du contact ou de l’inhalation peuvent être retardés. Le feu peut produire des gaz irritants, corrosifs et/ou toxiques. Les eaux de ruissellement provenant de l’eau de lutte contre l’incendie ou de dilution peuvent être corrosives et/ou toxiques et causer de la pollution.
Risque d’incendie
Non combustible, la substance elle-même ne brûle pas mais peut se décomposer lors du chauffage pour produire des fumées corrosives et / ou toxiques. Certains sont des oxydants et peuvent enflammer des combustibles (bois, papier, huile, vêtements, etc.). Le contact avec les métaux peut faire évoluer de l’hydrogène gazeux inflammable. Les conteneurs peuvent exploser lorsqu’ils sont chauffés.
Méthodes de purification
L’acide phosphoreux est un contaminant courant de l’acide hypophosphoreux commercial à 50 %. Jenkins et Jones ont purifié ce matériau en évaporant environ 600mL dans un ballon de 1L à 40o, sous pression réduite (en N2), jusqu’à un volume d’environ 300mL. Une fois la solution refroidie, elle a été transférée dans un Erlenmeyer à grande bouche qui a été bouché et laissé dans un bain de glace carbonique / acétone pendant plusieurs heures pour geler (si nécessaire, avec grattage de la paroi). Lorsque le ballon a ensuite été laissé à ca 5o pendant 12 heures, environ 30 à 40% de celui-ci s’est liquéfié et a été à nouveau filtré. Ce processus a été répété, puis le solide a été stocké sur Mg (ClO4) 2 dans un dessiccateur sous vide à froid. Les cristallisations ultérieures à partir du n-butanol en le dissolvant à température ambiante puis en le refroidissant dans un bain de sel de glace à -20o ne semblent pas le purifier davantage. L’acide libre forme des cristaux déliquescents m 26,5o et est soluble dans H2O et EtOH. Le sel NaH2PO2 peut être purifié par une résine échangeuse d’anions