Rendant le cycle aromatique disponible pour une attaque par des nucléophiles
La plupart des préparations de composés aromatiques que nous avons vues (telles que la substitution aromatique électrophile, ainsi que la réaction de Suzuki couverte dans la section précédente) impliquent le cycle aromatique en tant que nucléophile, réagissant avec un réactif électrophile. Substitution aromatique nucléophile (in 17.1.) implique des réactifs nucléophiles, mais elle est limitée aux cycles avec de forts groupes électron-retireurs ortho ou para à un groupe partant. La façon la plus polyvalente de rendre les cycles aromatiques disponibles pour une attaque nucléophile consiste à préparer des sels d’arènediazonium contenant l’ion ArN2+. Le diagramme ci-dessous montre la variété des réactions possibles avec les sels d’arènediazonium.

Les sels d’arènediazonium sont facilement préparés à partir d’arylamines (anilines) en utilisant un processus appelé diazotisation. Le procédé consiste à dissoudre l’amine dans un acide approprié, à refroidir dans un bain de glace à 0-5 oC, puis à ajouter une solution de nitrite de sodium (NaNO2). L’acide réagit avec le NaNO2 pour former de l’acide nitreux (HNO2), qui réagit ensuite avec l’arylamine pour former le sel d’arènediazonium. Le sel le plus commun à utiliser pour ces réactions est le chlorure (fabriqué en utilisant HCl comme acide), qui sont assez solubles mais se décomposent rapidement à température ambiante. Cependant, dans certaines réactions (telles que la formation de phénol), l’ion chlorure peut interférer et remplacer un Cl, de sorte que dans ces cas, le sulfate (fabriqué à l’aide de H2SO4) est utilisé. Les sulfates de diazonium sont un peu plus stables que les chlorures, mais ils sont également généralement moins solubles et donc plus difficiles à utiliser. Les tétrafluoroborates de diazonium sont fabriqués à partir de chlorures par addition d’HBF4; ils sont généralement complètement insolubles, ce qui permet de les filtrer, puis de les sécher pour les décomposer sans eau présente pour introduire un fluor sur le cycle. Cette méthode d’introduction de fluor sur un cycle aromatique est appelée réaction de Balz-Schiemann.
Les sels d’arènediazonium sont des intermédiaires utiles, et ils perdent facilement de l’azote en réaction avec une variété de nucléophiles, comme le montre le diagramme ci-dessus. L’azote étant très stable et perdu sous forme de gaz, cela fournit une force motrice puissante pour que ces réactions se produisent. Dans le cas de l’eau ou de l’ion iodure, le nucléophile réagit sans avoir besoin de catalyse. Cependant, de nombreuses réactions de sels de diazonium sont catalysées par le cuivre (I), auquel cas la réaction est appelée réaction de Sandmeyer.
Une réaction qui retient les deux nitrogènes implique un couplage à un autre cycle aromatique (riche en électrons), comme indiqué sur la partie gauche du schéma réactionnel. Ceci est très important dans l’industrie des colorants artificiels, qui a été principalement établie en utilisant la production de ces « colorants azoïques » après la découverte du mauve de Perkin en 1856.
Utilisation en synthèse
La chimie du sel de diazonium, basée sur des réactifs nucléophiles utilisés avec un cycle aromatique électrophile, est complémentaire de la substitution aromatique électrophile (EAS, qui utilise des réactifs électrophiles). Les sels de diazonium sont facilement préparés à partir d’aromatiques via une synthèse en trois étapes:

Si d’autres substituants sont nécessaires, ceux-ci peuvent être introduits lors de la synthèse. Si un méta-substituant est nécessaire, le substituant est introduit au stade nitro ou avant; pour les substituants ortho / para, cela peut être fait au stade NH2. Le groupe amino dans une arylamine (aniline) est un activateur très puissant, de sorte que de nombreuses réactions EAS d’arylamines introduisent rapidement 2 ou 3 substituants à moins que la réactivité du groupe NH2 ne soit modérée par la formation d’un amide – rappelons cette méthode de protection des amines par acétylation, du chapitre 16. Dans certains cas, le nouveau substituant peut également être réduit lors de la réduction du groupe nitro, comme dans cette synthèse de chlorure de méta-propylbenzènediazonium à partir de benzène:
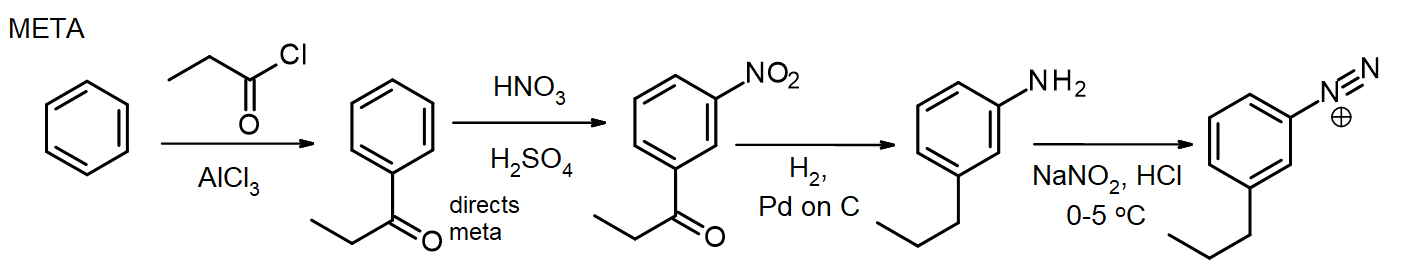
Pour la synthèse de l’isomère para, l’arylamine est acétylée avant la réaction de Friedel-Crafts, puis désacétylée par chauffage avec un excès d’aq. HCl juste avant la diazotisation.

Cette synthèse d’isomères para montre l’utilisation du groupe acétyle pour contrôler la réactivité du groupe amino. (Une synthèse alternative pourrait éviter cela en introduisant d’abord le groupe propyle, avant la nitration.) Bien que ces synthèses semblent longues, elles impliquent des étapes de synthèse fiables et reproductibles, et elles suivent un modèle standard. De plus, le fait que différents substituants puissent être introduits à des positions choisies en cours de route fait de cette approche une séquence synthétique très précieuse.