求核剤による芳香環の攻撃を可能にする
我々が見てきた芳香族化合物のほとんどの調製物(求電子性芳香族置換、前のセクションでカバーされた鈴木反応など)は、芳香族環を求電子試薬と反応させる求核剤として関与する。 求核芳香族置換(17.1.)は求核試薬を含むが、脱離基に強い電子吸引性基を有する環に限定される。 芳香環を求核攻撃に利用できるようにする最も汎用性の高い方法は、Arn2+イオンを含むアレンジアゾニウム塩を調製することである。 下の図は、アレンジアゾニウム塩で可能な様々な反応を示しています。

Arenediazoniumの塩はdiazotizationと呼ばれるプロセスを使用してアリールアミン(アニリン)から容易に準備されます。 このプロセスは、アミンを適切な酸に溶解し、氷浴中で0〜5℃に冷却し、亜硝酸ナトリウム(Nano2)溶液を添加することを含む。 酸はNano2と反応して亜硝酸(HNO2)を形成し、アリールアミンと反応してアレンジアゾニウム塩を形成する。 これらの反応に使用する最も一般的な塩は、かなり可溶性であるが室温で急速に分解する塩化物(酸としてHClを使用して作られる)である。 しかし、いくつかの反応(フェノール形成など)では、塩化物イオンがClを妨害して置換する可能性があるため、その場合には硫酸塩(H2SO4を使用して製 硫酸ジアゾニウムは塩化物よりも少し安定していますが、一般的には可溶性が低く、使用するのがより厄介です。 ジアゾニウムのtetrafluoroboratesは塩化物からHBF4を加えることによってなされます;それらはリングにフッ素を導入するためにそれらがろ過されるようにす 芳香環上にフッ素を導入するこの方法は、バルツ-シーマン反応と呼ばれる。
アレンジアゾニウム塩は有用な中間体であり、上の図に示すように、様々な求核剤と反応して窒素を失いやすい。 窒素は非常に安定であり、ガスとして失われるので、これはこれらの反応が起こるための強力な駆動力を提供する。 水またはヨウ化物イオンの場合には、求核剤は触媒作用のための必要性なしで反応します。 しかし、ジアゾニウム塩の多くの反応は銅(I)によって触媒され、その場合の反応はサンドマイヤー反応と呼ばれる。
反応スキームの左の部分に示すように、二つの窒素を保持する一つの反応は、別の(電子に富む)芳香族環に結合することを含む。 これは、1856年にパーキンの藤色が発見された後、主にこれらの”アゾ染料”の生産を使用して設立された人工染料産業において非常に重要です。
合成における使用
ジアゾニウム塩化学は、求電子芳香環とともに使用される求核試薬に基づくものであり、求電子芳香置換(求電子試薬を使用するEAS)に相補的である。 ジアゾニウム塩は、三段階合成を介して芳香族化合物から容易に調製される:

他の置換基が必要とされる場合、これらは合成中に導入することができる。 メタ置換基が必要とされる場合、置換基はニトロ段階またはその前に導入され、オルト/パラ置換基の場合、これはN H2段階で行うことができる。 アリールアミン(アニリン)中のアミノ基は非常に強力な活性化剤であるため、nh2基の反応性がアミドの形成によって緩和されない限り、アリールアミンの多くのEAS反応は急速に2または3個の置換基を導入する–第16章からアセチル化によるアミンの保護のためのこの方法を思い出してください。 いくつかの場合において、新しい置換基は、ベンゼンからのメタ-プロピルベンゼンジアゾニウム塩化物のこの合成のように、ニトロ基の還元中に還元:
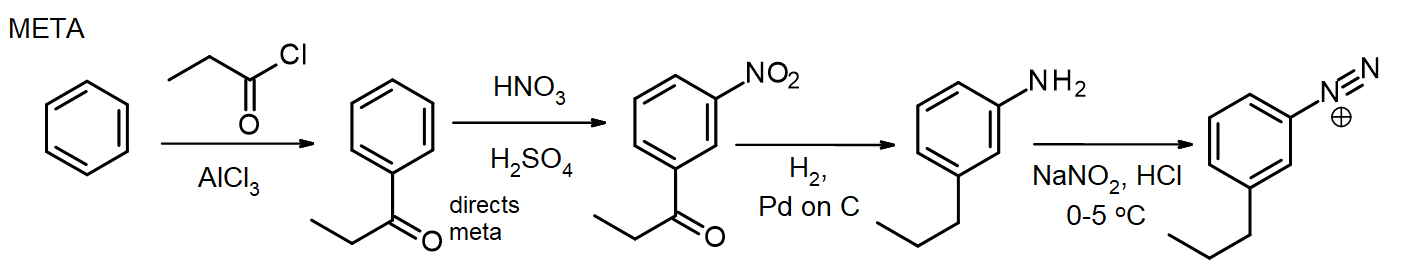
パラ異性体の合成のために、アリールアミンはフリーデル-クラフツ反応の前にアセチル化され、過剰なaqで加熱することによって脱アセチル化される。 ジアゾ化の直前のHCl。

このパラ異性体合成は、アミノ基の反応性を制御するためのアセチル基の使用を示す。 (代替合成は、ニトロ化の前にプロピル基を最初に導入することによってこれを回避することができる。)これらの合成は長いように見えますが、信頼性が高く再現性のある合成ステップを伴い、標準的なパターンに従います。 また、異なる置換基が途中で選択された位置に導入され得るという事実は、このアプローチを非常に貴重な合成配列にする。