udostępnianie pierścienia aromatycznego do ataku przez nukleofilów
większość preparatów związków aromatycznych, jakie widzieliśmy (takich jak elektrofilowa substytucja aromatyczna, jak również reakcja Suzukiego opisana w poprzednim rozdziale) obejmuje pierścień aromatyczny jako nukleofilowy, reagując z odczynnikiem elektrofilowym. Nukleofilowa substytucja aromatyczna (w 17.1.) obejmuje odczynniki nukleofilowe, ale ogranicza się do pierścieni z silnymi grupami wycofującymi elektrony Orto lub para do grupy opuszczającej. Najbardziej wszechstronnym sposobem udostępniania pierścieni aromatycznych do ataku nukleofilowego jest przygotowanie soli arenediazoniowych, zawierających jon ArN2+. Poniższy diagram pokazuje różnorodność możliwych reakcji z solami arenediazoniowymi.

sole Arenediazoniowe są łatwo wytwarzane z aryloamin (Anilin) za pomocą procesu zwanego diazotyzacją. Proces polega na rozpuszczeniu aminy w odpowiednim kwasie, schłodzeniu w łaźni lodowej do 0-5 oC, a następnie dodaniu roztworu azotynu sodu (NaNO2). Kwas reaguje z NaNO2 tworząc kwas azotowy (HNO2), który następnie reaguje z arylaminą, tworząc sól arenediazoniową. Najczęściej sól do stosowania w tych reakcjach jest chlorek (wykonane przy użyciu HCl jako kwas), które są dość rozpuszczalne, ale rozkładają się szybko w temperaturze pokojowej. Jednak w niektórych reakcjach (takich jak tworzenie fenolu) jon chlorkowy może zakłócać i zastępować Cl, więc w tych przypadkach stosuje się siarczan (wytwarzany przy użyciu H2SO4). Siarczany diazoniowe są nieco bardziej stabilne niż chlorki, ale są również ogólnie mniej rozpuszczalne, a tym samym bardziej kłopotliwe w użyciu. Tetrafluoroborany diazoniowe są wytwarzane z chlorków przez dodanie HBF4; zwykle są całkowicie nierozpuszczalne, co pozwala na ich filtrowanie, a następnie suszenie w celu rozkładu bez obecności wody w celu wprowadzenia fluoru na pierścień. Ten sposób wprowadzania fluoru do pierścienia aromatycznego nazywa się reakcją Balza-Schiemanna.
sole Arenediazoniowe są użytecznymi półproduktami i łatwo tracą azot reagując z różnymi nukleofilami, jak pokazano na powyższym diagramie. Ponieważ azot jest bardzo stabilny i tracony jako gaz, zapewnia to silną siłę napędową tych reakcji. W przypadku jonów wodnych lub jodkowych nukleofil reaguje bez potrzeby jakiejkolwiek katalizy. Jednak wiele reakcji soli diazoniowych jest katalizowanych przez miedź (I), w którym to przypadku reakcja jest określana jako reakcja Sandmeyera.
jedna reakcja, która zatrzymuje dwa nitrogeny, obejmuje sprzęganie z innym (bogatym w elektrony) pierścieniem aromatycznym, jak pokazano w lewej części schematu reakcji. Jest to bardzo ważne w przemyśle sztucznych barwników, który powstał głównie przy użyciu produkcji tych „barwników azowych” po odkryciu mauve Perkina w 1856 roku.
zastosowanie w syntezie
Chemia soli Diazoniowej, oparta na odczynnikach nukleofilowych stosowanych z elektrofilowym pierścieniem aromatycznym, jest komplementarna do elektrofilowej substytucji aromatycznej (EAS, która wykorzystuje odczynniki elektrofilowe). Sole diazoniowe są łatwo wytwarzane z substancji aromatycznych za pomocą trzyetapowej syntezy:

jeśli potrzebne są inne podstawniki, można je wprowadzić podczas syntezy. Jeśli potrzebny jest podstawnik meta, podstawnik jest wprowadzany na etapie nitro lub przed nim; w przypadku podstawników Orto/para można to zrobić na etapie NH2. Grupa aminowa w arylaminie (anilinie) jest bardzo silnym aktywatorem, więc wiele reakcji EAS arylamin szybko wprowadza 2 lub 3 podstawniki, chyba że reaktywność grupy NH2 jest moderowana przez tworzenie amidu – przypomnijmy tę metodę ochrony Amin przez acetylację, z rozdziału 16. W niektórych przypadkach nowy podstawnik może być również redukowany podczas redukcji grupy nitrowej, jak w tej syntezie chlorku meta-propylobenzenodiazoniowego z benzenu:
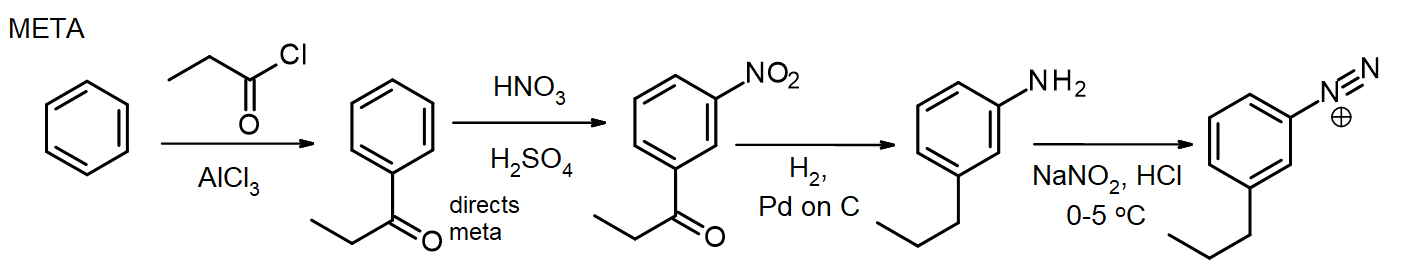
do syntezy izomeru para arylamina jest acetylowana przed reakcją Friedela-crafta, a następnie deacetylowana przez ogrzewanie nadmiarem AQ. HCl tuż przed diazotizacją.

ta synteza para izomerów pokazuje użycie grupy acetylowej do kontrolowania reaktywności grupy aminowej. (Alternatywna synteza mogłaby tego uniknąć, wprowadzając najpierw grupę propylową, przed nitracją.) Chociaż te syntezy wydają się być długie, obejmują syntetyczne kroki, które są wiarygodne i powtarzalne, i podążają za standardowym wzorem. Ponadto fakt, że różne podstawniki mogą być wprowadzane w wybranych pozycjach po drodze, sprawia, że takie podejście jest bardzo cenną sekwencją syntetyczną.