Bereitstellung des aromatischen Rings für den Angriff durch Nukleophile
Die meisten Zubereitungen von aromatischen Verbindungen, die wir gesehen haben (wie die elektrophile aromatische Substitution sowie die im vorherigen Abschnitt behandelte Suzuki-Reaktion), beinhalten den aromatischen Ring als Nukleophil und reagieren mit einem elektrophilen Reagens. Nucleophile aromatische Substitution (in 17.1.) beinhaltet nukleophile Reagenzien, ist jedoch auf Ringe mit starken elektronenziehenden Gruppen ortho oder para zu einer Abgangsgruppe beschränkt. Der vielseitigste Weg, aromatische Ringe für nukleophile Angriffe verfügbar zu machen, ist die Herstellung von Arendiazoniumsalzen, die das ArN2 + -Ion enthalten. Das folgende Diagramm zeigt die Vielfalt der Reaktionen, die mit Arendiazoniumsalzen möglich sind.

Arendiazoniumsalze lassen sich leicht aus Arylaminen (Anilinen) unter Verwendung eines als Diazotierung bezeichneten Verfahrens herstellen. Das Verfahren besteht darin, das Amin in einer geeigneten Säure aufzulösen, in einem Eisbad auf 0-5 oC abzukühlen und dann Natriumnitrit (NaNO2) -Lösung zuzugeben. Die Säure reagiert mit dem NaNO2 unter Bildung von salpetriger Säure (HNO2), die dann mit dem Arylamin unter Bildung des Arendiazoniumsalzes reagiert. Das gebräuchlichste Salz, das für diese Reaktionen verwendet wird, ist das Chlorid (hergestellt unter Verwendung von HCl als Säure), die ziemlich löslich sind, sich aber bei Raumtemperatur schnell zersetzen. Bei einigen Reaktionen (wie der Phenolbildung) kann das Chloridion jedoch stören und ein Cl ersetzen, so dass in diesen Fällen das Sulfat (hergestellt unter Verwendung von H2SO4) verwendet wird. Diazoniumsulfate sind etwas stabiler als Chloride, aber sie sind im Allgemeinen auch weniger löslich und daher umständlicher zu verwenden. Diazoniumtetrafluoroborate werden aus Chloriden durch Zugabe von HBF 4 hergestellt; Sie sind normalerweise vollständig unlöslich, wodurch sie abfiltriert und dann zur Zersetzung getrocknet werden können, ohne dass Wasser vorhanden ist, um ein Fluor auf den Ring einzuführen. Diese Methode zur Einführung von Fluor in einen aromatischen Ring wird als Balz-Schiemann-Reaktion bezeichnet.
Arendiazoniumsalze sind nützliche Zwischenprodukte, und sie verlieren leicht Stickstoff reagieren mit einer Vielzahl von Nukleophilen, wie im obigen Diagramm gezeigt. Da Stickstoff sehr stabil ist und als Gas verloren geht, stellt dies eine starke treibende Kraft für diese Reaktionen dar. Im Falle von Wasser oder Jodidion reagiert das Nukleophil ohne Katalyse. Viele Reaktionen von Diazoniumsalzen werden jedoch durch Kupfer(I) katalysiert, wobei die Reaktion als Sandmeyer-Reaktion bezeichnet wird.
Eine Reaktion, bei der die beiden Stickstoffatome erhalten bleiben, beinhaltet die Kopplung an einen anderen (elektronenreichen) aromatischen Ring, wie im linken Teil des Reaktionsschemas gezeigt. Dies ist sehr wichtig in der künstlichen Farbstoffindustrie, die hauptsächlich mit der Herstellung dieser „Azofarbstoffe“ nach der Entdeckung von Perkins Mauve im Jahr 1856 gegründet wurde.
Verwendung in der Synthese
Die Diazoniumsalzchemie basiert auf nukleophilen Reagenzien, die mit einem elektrophilen aromatischen Ring verwendet werden, und ist komplementär zur elektrophilen aromatischen Substitution (EAS, die elektrophile Reagenzien verwendet). Diazoniumsalze lassen sich leicht aus Aromaten über eine dreistufige Synthese herstellen:

Falls andere Substituenten benötigt werden, können diese während der Synthese eingeführt werden. Wenn ein Metasubstituent benötigt wird, wird der Substituent auf oder vor der Nitrostufe eingeführt; für Ortho / Para-Substituenten kann dies auf der NH2 -Stufe erfolgen. Die Aminogruppe in einem Arylamin (Anilin) ist ein sehr starker Aktivator, so dass viele EAS–Reaktionen von Arylaminen schnell 2 oder 3 Substituenten einführen, es sei denn, die Reaktivität der NH2-Gruppe wird durch Bildung eines Amids moderiert – erinnern Sie sich an diese Methode zum Schutz von Aminen durch Acetylierung aus Kapitel 16. In einigen Fällen kann der neue Substituent auch während der Reduktion der Nitrogruppe reduziert werden, wie bei dieser Synthese von Metapropylbenzoldiazoniumchlorid aus Benzol:
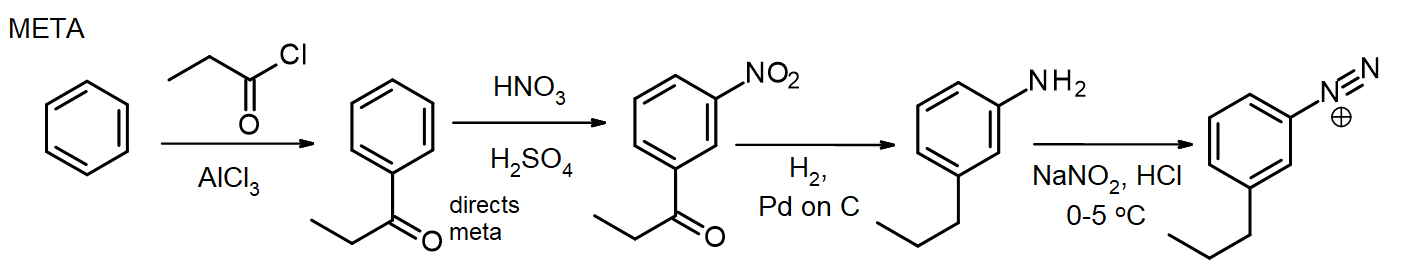
Zur Synthese des Paraisomeren wird das Arylamin vor der Friedel-Crafts-Reaktion acetyliert und anschließend durch Erhitzen mit überschüssigem aq deacetyliert. HCl kurz vor der Diazotierung.

Diese Paraisomersynthese zeigt die Verwendung der Acetylgruppe zur Steuerung der Reaktivität der Aminogruppe. (Eine alternative Synthese könnte dies vermeiden, indem zuerst die Propylgruppe vor der Nitrierung eingeführt wird. Obwohl diese Synthesen lang zu sein scheinen, beinhalten sie synthetische Schritte, die zuverlässig und reproduzierbar sind, und sie folgen einem Standardmuster. Auch die Tatsache, dass verschiedene Substituenten an ausgewählten Positionen entlang des Weges eingeführt werden können, macht diesen Ansatz zu einer sehr wertvollen synthetischen Sequenz.