INTRODUCTION
Depuis sa première description en 1924, l’endocardite de Libman-Sacks est considérée comme le trouble cardiaque le plus caractéristique du lupus érythémateux disséminé (LED), bien que pas le plus fréquent.
La fréquence des troubles endocardiques dans le LED varie en fonction de la technique diagnostique utilisée, bien que le diagnostic clinique soit peu fréquent. Selon l’expérience de certains auteurs, les lésions sont cliniquement significatives chez seulement 20% des patients1 et progressent généralement lentement après avoir souffert de la maladie pendant de nombreuses années.1,2
Dans les rares cas où une réparation valvulaire chirurgicale est nécessaire, les valves bioprothétiques ne sont pas recommandées, car elles peuvent entraîner une endocardite par des sacs de libman3; cependant, la littérature médicale est controversée à ce sujet.
Nous présentons un cas d’endocardite Libman-Sacks impliquant la valve mitrale avec progression rapide vers une régurgitation sévère traitée par chirurgie réparatrice via une annuloplastie mitrale.
CAS CLINIQUE
Femme, 36 ans, atteinte d’une maladie du tissu conjonctif, présentant des critères cliniques incomplets pour LE LED pendant 8 ans, une vascularite de petits vaisseaux et des fausses couches répétées, sans symptômes cardiologiques antérieurs.
Admis pour dyspnée au repos et expectorations sanglantes marquées; lors de l’exploration, elle a présenté une tachypnée, une augmentation de la pression veineuse centrale, des râles bilatéraux jusqu’au champ pulmonaire moyen et un souffle mitral pansystolique de grade IV / VI. Elle présentait également des lésions de vascularite distale au niveau des doigts et des orteils. L’analyse de routine a révélé une anémie avec 9,3 g / dL d’hémoglobine. Des tests répétés pour détecter les anticorps antiphospholipides se sont révélés négatifs.
L’électrocardiogramme a démontré une tachycardie sinusale sans autres anomalies associées. La radiographie pulmonaire à l’admission a montré une cardiomégalie légère et un profil pulmonaire interstitiel basilaire bilatéral.
L’échocardiographie transthoracique et transoesophagienne a montré des épaississements nodulaires en verrucose mobiles de 2 à 3 mm dans les deux valves mitrales, indicatifs d’une endocardite de Libman-Sacks (Figure 1) et d’une régurgitation mitrale sévère (Figure 2). La taille systolique et la fonction des deux ventricules ont été préservées.
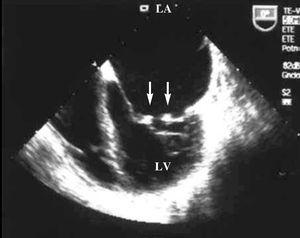
Figure 1. Échocardiogramme transoesophagien: projection apicale à 4 chambres où de petites végétations peuvent être observées sur les deux valves mitrales (flèches). LA indique l’oreillette gauche; LV, ventricule gauche.

Figure 2. Échocardiogramme transoesophagien: projection à 79 degrés où une régurgitation mitrale sévère est visualisée. LA indique l’oreillette gauche; LV, ventricule gauche.
L’échocardiographie transthoracique a été réalisée 2 ans plus tôt. Des épaississements nodulaires de quelques millimètres ont été observés dans la valve mitrale et une régurgitation mitrale légère compatible avec l’endocardite de Libman-Sacks.
Compte tenu de la suspicion d’hémorragie pulmonaire intraparenchymateuse, une tomographie informatisée à haute résolution a été demandée pour confirmer le diagnostic (images montrant des masses bilatérales avec opacité du verre broyé).
Evolution
Après des corticostéroïdes à forte dose et un traitement diurétique intensif, l’hémoptysie a été éliminée et l’insuffisance cardiaque marquée contrôlée. Cependant, le patient est resté en grade fonctionnel III grâce auquel, 4 mois après la première admission, la cardiopathie valvulaire a été traitée par chirurgie extracorporelle et réparation de la valve mitrale (en raison du risque élevé de saignement chez ce patient) avec un anneau de Carpentier.
La visualisation macroscopique de la valve a montré des granulomes de 2 à 3 mm et l’anatomie pathologique a montré des fragments avec des dépôts de fibrine et une calcification focale non spécifique, mais compatibles avec le diagnostic clinique.
Un an plus tard, le patient restait indemne de symptômes cardiologiques; l’échocardiogramme a montré une régurgitation mitrale résiduelle légère similaire à celle de la décharge post-chirurgicale.
DISCUSSION
L’endocardite de Libman-Sacks est caractérisée par des lésions de verrucose sur les surfaces valvulaires, bien qu’elles se trouvent également sur les marges libres des valves et, en général, dans n’importe quelle zone de l’endocarde auriculaire ou ventriculaire; l’histologie de la verrue est généralement non spécifique.4
L’échocardiographie Doppler peut être considérée comme la technique de choix pour le diagnostic, avec une incidence de maladie valvulaire comprise entre 18% et 50% 1,5,6 et jusqu’à 74% si l’échocardiographie transoesophagienne est utilisée.7
Cette incidence est cependant beaucoup plus élevée que le nombre de patients atteints de lupus présentant des lésions cliniquement importantes, représentant environ 20% des cas.1
Bien que l’origine des lésions valvulaires dans le LED soit étroitement liée à la présence d’anticorps antiphospholipidiques,4 des résultats de tests négatifs, comme dans notre cas, sont décrits dans la littérature médicale chez d’autres patients atteints d’endocardite du LED et des sacs Libman8 ou même dans une endocardite thrombotique non bactérienne sans maladie sous-jacente.9 Cela s’explique probablement par le fait qu’actuellement toutes les situations prothrombotiques pouvant conduire à l’apparition de ces lésions restent indéfinies.
Chez notre patient, l’échocardiographie a montré de petites lésions multiples mobiles au verrucose dans les marges libres de la valve mitrale, à la fois en échocardiographie transthoracique et transoesophagienne (Figure 1).
Le trouble fonctionnel le plus fréquent est la régurgitation, comme dans ce cas. Cependant, lorsque la maladie n’a progressé que depuis quelques années, que le patient est jeune et que le lupus est actif, les lésions valvulaires sont rarement suffisamment graves pour induire une insuffisance cardiaque.1,2,10
Dans notre cas, une étude échocardiographique 2 ans plus tôt, démontrant des végétations Libman-Sacks et une régurgitation mitrale légère, permet de démontrer une progression rapide vers une régurgitation mitrale massive avec insuffisance cardiaque congestive, en raison de laquelle une intervention chirurgicale a été indiquée. Il y a à peine cinquante cas publiés dans la littérature médicale sur la réparation de la valve mitrale due au LED; dans une étude prospective, il a été démontré que 8% des patients ont finalement besoin d’une chirurgie cardiaque.1
Le traitement des patients atteints de valvulopathie associée au lupus comprend une prophylaxie de l’endocardite, un traitement antiagrégant ou anticoagulant dans certains cas et un remplacement valvulaire lorsque le trouble valvulaire est sévère11; le rôle du traitement par corticostéroïdes concernant cette valvulopathie reste indéterminé.11 Controverse existe concernant le type d’intervention chirurgicale. Certains auteurs suggèrent la supériorité des prothèses mécaniques dans ce type de trouble par rapport aux bioprothèses, y compris les homogreffes cryoconservées, car ces dernières peuvent entraîner une valvulite lupique sur la nouvelle valve.3,12-14 Cependant, d’autres auteurs15 ont préconisé la chirurgie reconstructrice pour éviter les inconvénients d’une prothèse mécanique chez les jeunes patients qui ont normalement besoin de fortes doses de corticostéroïdes et d’un traitement anticoagulant et qui ont une incidence élevée d’insuffisance rénale.
Dans notre cas, les 2 épisodes récents d’hémorragie pulmonaire massive avec hémoptysie sévère, et la nécessité de fortes doses de corticostéroïdes pour contrôler la maladie ont guidé le choix de la chirurgie réparatrice de la valve. Bien que l’évolution du patient devra être surveillée dans les années à venir via des études échocardiographiques en série, 1 an après la chirurgie, l’état de la réparation valvulaire est optimal.