はじめに
1924年の初期の記述以来、Libman-Sacks心内膜炎は、最も頻繁ではないが、全身性エリテマトーデス(sle)の最も特徴的な心疾患と考えられてきた。
sleにおける心内膜障害の頻度は、使用される診断技術によって異なるが、臨床診断はまれである。 いくつかの著者の経験では、病変は患者のわずか20%で臨床的に有意であり1、彼らは長年にわたって病気を持っていた後、通常はゆっくりと進行します。1,2
外科的弁修復が必要な少数の症例では、生体人工弁はLibman-Sacks心内膜炎につながる可能性があるため推奨されない3;しかし、これに関連して医学文献に論争がある。
僧帽弁を伴うLibman-Sacks心内膜炎の症例を提示し、僧帽弁輪形成術を介した修復手術で治療された重度の逆流に急速に進行した。
臨床例
女性、36歳、結合組織疾患と診断され、8年間のSLEの不完全な臨床基準、小血管血管炎および反復流産を提示し、以前の心臓学的症状はない。
安静時呼吸困難と著しい血球喀痰のため入院; 調査で彼女は頻呼吸、中心静脈圧の増加、中肺野までの両側のrales、およびグレードIV/VI pansystolic僧帽弁雑音を提示しました。 また,指および足指に遠位血管炎病変を呈した。 ルーチン分析は、ヘモグロビン9.3g/dLと貧血を明らかにした。 抗リン脂質抗体の反復試験は陰性であった。
心電図では洞性頻脈が認められたが、他の異常は認められなかった。 入院時の胸部x線写真では軽度の心肥大と両側基底間質肺パターンを示した。
経胸腔および経食道心エコー検査では、Libman-Sacks心内膜炎(図1)と重度の僧帽弁逆流(図2)を示す僧帽弁の両方に2-3mmの可動性verrucose結節の肥厚を示した。 両心室の収縮期の大きさと機能は保存されていた。
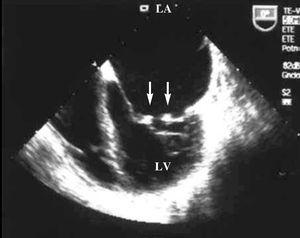
図1. 経食道心エコー図:両方の僧帽弁(矢印)に小さな植生を観察することができる頂端4室投影。 LAは左心房を示し、LVは左心室を示す。

図2. 経食道心エコー図:重度の僧帽弁逆流が視覚化される79度の投影。 LAは左心房を示し、LVは左心室を示す。
経胸腔内心エコー検査は2年前に行われた。 僧帽弁には数ミリメートルの大きさの結節性肥厚が見られ,軽度の僧帽弁逆流はLibman-Sacks心内膜炎と一致した。
実質内肺出血の疑いがあることから、診断を確認するために高解像度のコンピュータ断層撮影を要求された(ガラス混濁を伴う両側腫瘤を示す画像)。
Evolution
高用量のコルチコステロイドと集中的な利尿治療の後、喀血は排除され、著しい心不全は制御された。 しかし、患者は機能グレードIIIにとどまっており、最初の入院から4ヶ月後、心臓弁疾患は体外手術と僧帽弁修復(この患者では出血のリスクが高いため)を介してCarpentierリングで治療された。
バルブの肉眼的可視化は2-3mmの肉芽腫を示し、病理学的解剖学はフィブリン沈着および非特異的な局所石灰化を有する断片を示したが、臨床診断
一年後、患者は心臓学的症状のないままであった; 心エコー図では術後退院時と同様の軽度の僧帽弁逆流を示した。
DISCUSSION
Libman-Sacks心内膜炎は、弁表面にverrucose病変を特徴とするが、弁の自由縁、一般に心房または心室心内膜の任意の領域にも見られる。verruca組織学は通常非特異的である。4
ドップラー心エコー検査は、診断のための選択の技術と考えることができ、弁疾患の発生率は18%から50%1,5,6、経食道心エコー検査を使用する場合は最大74%である。7
しかし、この発生率は、臨床的に重要な病変を示すループス患者の数よりもはるかに高く、症例の約20%を占めています。1
SLEの弁膜病変の起源は抗リン脂質抗体の存在と密接に関連しているが、4つの陰性検査結果は、私たちの場合のように、SLEおよびLibman-Sacks心内膜炎8の他の患者、または根底にある疾患のない非細菌性血栓性心内膜炎の医学文献に記載されている。9これは、おそらく、現在、これらの病変の出現につながる可能性のあるすべての血栓症の状況が未定義のままであるという事実によって説明される。
私たちの患者では、心エコー検査では、経胸腔および経食道心エコー検査の両方で、僧帽弁遊離縁に小さな複数の可動性verrucose病変を示した(図1)。
最も頻繁な機能障害は、この場合のように逆流である。 しかし、この疾患が数年しか進行しておらず、患者が若く、狼瘡が活動的である場合、弁膜病変は心不全を誘発するのに十分に深刻ではない。1,2,10
私たちのケースでは、2年前の心エコー検査では、Libman-Sacks vegetationsと軽度の僧帽弁逆流を実証し、うっ血性心不全を伴う大規模な僧帽弁逆流への急速な進行を実証することが可能になり、外科的介入が示唆された。 Sleによる僧帽弁修復に関する医学文献に掲載されている症例はほとんどなく、前向き研究では、患者の8%が最終的に心臓手術を必要とすることが示1
ループス関連弁膜症の患者の治療には、心内膜炎の予防、選択された症例における抗凝集剤または抗凝固剤の治療、および弁障害が重度の場合の弁置換11が含まれるが、この弁膜症に関するコルチコステロイド治療の役割は未決定のままである。11外科的介入のタイプに関する論争が存在する。 いくつかの著者は、後者が新しい弁の狼瘡弁膜炎につながる可能性があるため、このタイプの障害と凍結保存された同種移植片を含むバイオプロテーゼとの間で機械的プロテーゼの優位性を示唆している。3,12-14しかし、他の著者15は、通常、高用量のコルチコステロイドおよび抗凝固療法を必要とし、腎不全の発生率が高い若い患者における機械的プロテーゼの欠点を避けるために再建手術を提唱している。
私たちの場合、重度の喀血を伴う大量の肺出血の2つの最近のエピソード、および疾患を制御するための高用量のコルチコステロイドの必要性が、弁の修復手術の選択を導いた。 患者の進化は、連続的な心エコー検査を介して今後数年間監視されなければならないが、手術後1年は弁膜修復の状態が最適である。