EINLEITUNG
Seit ihrer frühen Beschreibung im Jahr 1924 gilt die Libman-Sacks-Endokarditis als die charakteristischste Herzerkrankung des systemischen Lupus erythematodes (SLE), wenn auch nicht die häufigste.
Die Häufigkeit einer endokardialen Störung bei SLE variiert je nach verwendeter Diagnosetechnik, obwohl eine klinische Diagnose ungewöhnlich ist. Nach den Erfahrungen einiger Autoren sind die Läsionen bei nur 20% der Patienten klinisch signifikant1 und schreiten in der Regel langsam voran, nachdem sie die Krankheit viele Jahre lang hatten.1,2
In den wenigen Fällen, in denen eine chirurgische Klappenreparatur erforderlich ist, werden bioprothetische Klappen nicht empfohlen, da diese zu einer Libman-Sacks-Endokarditis führen können3; In Bezug darauf gibt es jedoch Kontroversen in der medizinischen Literatur.
Wir präsentieren einen Fall von Libman-Sacks-Endokarditis mit Beteiligung der Mitralklappe mit schnellem Fortschreiten zu schwerer Regurgitation, die mit einer reparativen Operation über eine Mitralanuloplastik behandelt wurde.
KLINISCHER FALL
Frau, 36 Jahre alt, mit Bindegewebserkrankung diagnostiziert, mit unvollständigen klinischen Kriterien für SLE seit 8 Jahren, Kleingefäßvaskulitis und wiederholten Fehlgeburten, ohne vorherige kardiologische Symptome.
Zugelassen für ruhende Dyspnoe und ausgeprägten blutigen Auswurf; bei der Exploration präsentierte sie Tachypnoe, erhöhten zentralvenösen Druck, bilaterale Rasseln bis zum mittleren Lungenfeld und pansystolisches Mitralgeräusch Grad IV / VI. Sie zeigte auch distale Vaskulitisläsionen in den Fingern und Zehen. Routineanalyse ergab Anämie mit Hämoglobin 9,3 g/dl. Wiederholte Tests auf Antiphospholipid-Antikörper erwiesen sich als negativ.
Das Elektrokardiogramm zeigte eine Sinustachykardie ohne andere damit verbundene Anomalien. Die Röntgenaufnahme des Brustkorbs bei der Aufnahme zeigte eine leichte Kardiomegalie und ein bilaterales basilares interstitielles Lungenmuster.
Die transthorakale und transösophageale Echokardiographie zeigte in beiden Mitralklappen mobile Verrukoseknotenverdickungen von 2-3 mm, die auf eine Libman-Sacks-Endokarditis (Abbildung 1) und eine schwere Mitralinsuffizienz (Abbildung 2) hindeuteten. Die systolische Größe und Funktion beider Ventrikel blieben erhalten.
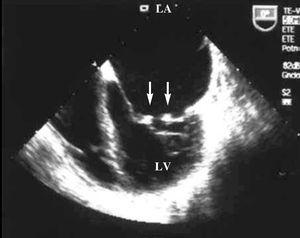
Abbildung 1. Transösophageales Echokardiogramm: Apikale 4-Kammer-Projektion, bei der an beiden Mitralklappen kleine Vegetationen beobachtet werden können (Pfeile). LA zeigt linken Vorhof an; LV, linker Ventrikel.

Abbildung 2. Transösophageales Echokardiogramm: 79-Grad-Projektion, bei der eine schwere Mitralinsuffizienz sichtbar gemacht wird. LA zeigt linken Vorhof an; LV, linker Ventrikel.
Die transthorakale Echokardiographie wurde 2 Jahre zuvor durchgeführt. In der Mitralklappe wurden knotige Verdickungen von wenigen Millimetern Größe und leichte Mitralinsuffizienz beobachtet, die mit einer Libman-Sacks-Endokarditis kompatibel waren.
Bei Verdacht auf eine intraparenchymale Lungenblutung wurde eine hochauflösende Computertomographie angefordert, die die Diagnose bestätigte (Bilder mit beidseitigen Massen mit gemahlener Glastrübung).
Evolution
Nach hochdosierten Kortikosteroiden und intensiver diuretischer Behandlung wurde die Hämoptyse eliminiert und die ausgeprägte Herzinsuffizienz kontrolliert. Der Patient blieb jedoch im funktionellen Grad III, wodurch 4 Monate nach der ersten Aufnahme die Herzklappenerkrankung über eine extrakorporale Operation und eine Mitralklappenreparatur (aufgrund des hohen Blutungsrisikos bei diesem Patienten) mit einem Carpentier-Ring behandelt wurde.
Die makroskopische Visualisierung der Klappe zeigte 2-3 mm Granulome und die pathologische Anatomie zeigte Fragmente mit Fibrinablagerungen und unspezifischer fokaler Verkalkung, die jedoch mit der klinischen Diagnose vereinbar waren.
Ein Jahr später blieb der Patient frei von kardiologischen Symptomen; das Echokardiogramm zeigte eine leichte restliche Mitralinsuffizienz ähnlich der bei der Entlassung nach der Operation.
DISKUSSION
Die Libman-Sacks-Endokarditis ist durch Verrukoseläsionen an den Klappenoberflächen gekennzeichnet, obwohl sie auch an den freien Rändern der Klappen und im Allgemeinen in jedem Bereich des atrialen oder ventrikulären Endokards zu finden sind; Die Verruca-Histologie ist normalerweise unspezifisch.4
Doppler-Echokardiographie kann als die Technik der Wahl für die Diagnose angesehen werden, mit einer Inzidenz von Klappenerkrankungen zwischen 18% und 50%1,5,6 und bis zu 74%, wenn transösophageale Echokardiographie verwendet wird.7
Diese Inzidenz ist jedoch viel höher als die Anzahl der Patienten mit Lupus, die klinisch wichtige Läsionen aufweisen, was etwa 20% der Fälle entspricht.1
Obwohl der Ursprung von Klappenläsionen bei SLE eng mit dem Vorhandensein von Antiphospholipid-Antikörpern zusammenhängt,4 Negative Testergebnisse, wie in unserem Fall, werden in der medizinischen Literatur bei anderen Patienten mit SLE und Libman-Sacks-Endokarditis8 oder sogar bei nichtbakterieller thrombotischer Endokarditis ohne Grunderkrankung beschrieben.9 Dies wird wahrscheinlich durch die Tatsache erklärt, dass derzeit alle prothrombotischen Situationen, die zum Auftreten dieser Läsionen führen können, undefiniert bleiben.
Bei unserem Patienten zeigte die Echokardiographie sowohl in der transthorakalen als auch in der transösophagealen Echokardiographie kleine multiple mobile Verrukoseläsionen in den freien Rändern der Mitralklappe (Abbildung 1).
Die häufigste Funktionsstörung ist Regurgitation, wie in diesem Fall. Wenn die Krankheit jedoch nur wenige Jahre fortgeschritten ist, der Patient jung ist und Lupus aktiv ist, sind die Klappenläsionen selten schwerwiegend genug, um eine Herzinsuffizienz auszulösen.1,2,10
In unserem Fall ermöglicht eine echokardiographische Studie 2 Jahre zuvor, die Libman-Sacks-Vegetationen und leichte Mitralinsuffizienz zeigte, ein schnelles Fortschreiten zu massiver Mitralinsuffizienz mit kongestiver Herzinsuffizienz, aufgrund derer ein chirurgischer Eingriff indiziert war. Es gibt kaum fünfzig Fälle, die in der medizinischen Literatur zur Mitralklappenreparatur aufgrund von SLE veröffentlicht wurden; In einer prospektiven Studie wurde gezeigt, dass 8% der Patienten schließlich eine Herzoperation benötigen.1
Die Behandlung der Patienten mit Lupus-assoziierter Valvulopathie umfasst Endokarditisprophylaxe, Antiaggregant oder Antikoagulans Behandlung in ausgewählten Fällen und Klappenersatz bei schwerer Klappenerkrankung 11; Die Rolle der Kortikosteroidbehandlung in Bezug auf diese Valvulopathie bleibt unbestimmt.11 Es gibt Kontroversen über die Art des chirurgischen Eingriffs. Einige Autoren schlagen die Überlegenheit mechanischer Prothesen bei dieser Art von Störung gegenüber Bioprothesen vor, einschließlich kryokonservierter Homotransplantate, da letztere zu einer Lupus-Valvulitis an der neuen Klappe führen können.3,12-14 Andere Autoren15 haben sich jedoch für eine rekonstruktive Chirurgie ausgesprochen, um die Nachteile einer mechanischen Prothese bei jungen Patienten zu vermeiden, die normalerweise hohe Dosen von Kortikosteroiden und Antikoagulanzien benötigen und bei denen Nierenversagen häufig auftritt.
In unserem Fall leiteten die 2 jüngsten Episoden massiver Lungenblutungen mit schwerer Hämoptyse und die Notwendigkeit hoher Dosen von Kortikosteroiden zur Kontrolle der Krankheit die Wahl der reparativen Operation der Klappe. Obwohl die Entwicklung des Patienten in den kommenden Jahren über serielle echokardiographische Studien überwacht werden muss, ist der Zustand der Klappenreparatur 1 Jahr nach der Operation optimal.