a Finegoldia magna szigorúan anaerob gram-pozitív coccus, amely a bőr, a szájüreg, a gyomor-bél traktus és a női urogenitális traktus kommensális flórájának része.1,2 leírjuk a bonyolult gluteális tályog szokatlan esetét, amelyet kizárólag egy opportunista kórokozó okoz egy cukorbetegségben szenvedő betegnél, aki korábban nem kapott intramuszkuláris injekciót az érintett területen.
egy 60 éves férfi intenzív fájdalommal és töméssel érkezett a sürgősségi osztályra a bal fenékben, amely 2 héttel korábban kezdődött. A beteg múltbeli története magában foglalta a magas vérnyomást, a diszlipidémiát, a túlsúlyt (testtömeg-index, 29), a vitiligót, az aktív dohányzást (napi 20 cigaretta) és a 2-es típusú diabetes mellitust, 12 éves időtartamú, jó glikémiás kontroll mellett, metadiabetikus szövődmények (HbA1, 7%) bizonyítéka nélkül, bár az elmúlt hetekben a glikémiás kontroll romlásáról számolt be otthon, egybeesve a fertőző folyamattal. A beteg korábban nem számolt be glutealis intramuscularis injekciókról. Acetilszalicilsavval (100 mg/24 óra), atorvasztatinnal (10 mg/24 óra), glimepiriddel (2 mg/24 óra) és biszoprolollal (5 mg/24 óra) kezelték.
a fizikális vizsgálat nagy, fájdalmas, forró ingadozó duzzanatot tárt fel a bal fenéken, melyet crepitus és aktív szupupáció kísér, és 10 cm-es nekrotikus terület (ábra. 1). A laboratóriumi vizsgálatok a következőket tárták fel: hemoglobin, 15 g / dL; leukociták; 10 870 mm3; vérlemezkék, 121 000 mm3; protrombin idő, 16%; glükóz, 370 mg / dL; karbamid, 67 mg / dL; kreatinin, 1,25 mg / dL; tejsav 2 mmol / L; prokalcitonin, 1,19 ng / mL; C-reaktív fehérje, 249 mg / L.
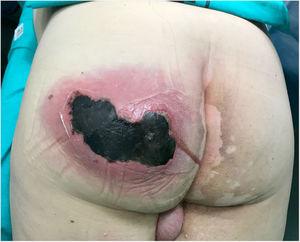
tályog a bal fenéken aktív töméssel és nagy (10 cm) nekrózis területtel.
a klinikai eredmények alapján a beteg sürgősségi vízelvezetésen esett át a műtőben. Egy liter gennyet extraháltunk, mintákat vettünk tenyésztésre, a nekrotikus szövet széles kivágását végeztük. A posztoperatív időszakban a beteg kedvező klinikai lefolyást mutatott, helyreállítva a glikémiás kontrollt, valamint a bal láb mobilitását és funkcionalitását.
a Tályogkultúrák negatívak voltak az aerob baktériumok számára, és csak a szigorúan anaerob gram-pozitív cocci-k esetében pozitívak, amelyeket a bakteriális tipizálás F magna-ként azonosított. Az F magna antibiogramja érzékenységet mutatott az amoxicillin-klavulánsavra, a metronidazolra és a klindamicinre, és nem mutatott antibiotikum-rezisztenciát. A beteget kiengedték a kórházból, és antibiotikumos kezelést (metronidazol, 500 mg/8 óra) és járóbeteg sebészeti sebkezelést írtak elő, amelyre jól reagált.
az F magna, korábban Peptostreptococcus magnus néven ismert, több rendszertani változáson ment keresztül, mióta Prevot 1933-ban először leírta, aki a Diplococcus magnus kifejezést használta.3
az F magna valószínűleg a leggyakoribb az összes gram-pozitív anaerob cocci (GPAC) és a legpatogénebb forma, amelyet az emberi klinikai mintákban találtak. Ez a mikroorganizmus a normál bióta része, és elsősorban a bőrben, a gyomor-bél traktusban, a női urogenitális traktusban és kisebb mértékben a szájüregben található.1,2 az elmúlt években 2 fontos fehérjét azonosítottak, amelyek magyarázzák az F magna virulenciáját és kolonizációs képességét: a FAF felületi adhéziós fehérjét (F magna adhéziós faktor) és a szubtilizinszerű szerin proteáz SufA-t.2,4 az epidermisz felső rétegeiben az FAF közvetíti az adhéziót azáltal, hogy kötődik a galektin-7-hez, egy keratinocita sejt markerhez. Miután a baktériumok mélyebbre hatolnak a bőrbe, és elérik a bazális membránt, a SufA lebontja a kollagén IV-et. a dermisben a FAF kölcsönhatásba lép a kollagén V-vel és a fibrillinnel, ami feltehetően megmagyarázza, hogy az F magna hogyan érheti el a bőrszövet legmélyebb rétegeit a fertőzés során.5
az F magna a bőr, a lágy szövetek, a csontok és az ízületek tályogaiból leggyakrabban tenyésztett fajok egyike, általában polimikrobiális kultúrákban és ritka esetekben tiszta kultúrákban.3 posztoperatív mediastinitist, protézisbillentyű endocarditist és nekrotizáló tüdőgyulladást írtak le az F magna miatt.6. a bőr mikrobiotáját megváltoztató széles spektrumú antibiotikumok alkalmazása, idegen anyagok (protézisbillentyűk, pótló ízületek, katéterek) bevezetése, valamint az immunszuppresszív gyógyszerekkel kezelt betegek számának növekedése elősegíti ezeket a fertőzéseket azáltal, hogy optimális környezetet teremt ezen opportunista kórokozók számára.
az anaerob baktériumok antimikrobiális rezisztenciája világszerte növekszik.7 a legtöbb GPAC (>90%) érzékeny a penicillinre, és sokan más,7-10 év közötti laktám antibiotikumokra is érzékenyek, de növekvő rezisztenciát mutatnak más antibiotikumokkal, például klindamicinnel, metronidazollal és fluorokinolonokkal szemben.8-10 a klindamicin rezisztencia aránya a GPAC-k között 7% és 20% között mozog, de bizonyos fajokban növekszik, beleértve az F magna és a Peptoniphilus fajokat.7 a legtöbb GPAC még mindig érzékeny a metronidazolra, bár az F magna és a Parvimonas micra néhány metronidazol-rezisztens törzsét leírták.9
a jelen eset szemlélteti, hogy az F magna kommenzális baktérium hogyan képes előrehaladott nekrotizáló fertőzést előidézni, és hangsúlyozza az anaerob baktériumok reprezentatív mintákból történő fajszintű azonosításának és antimikrobiális érzékenységének meghatározásának fontosságát, ha tiszta tenyészetekben izolálják őket.
összeférhetetlenség
a szerzők kijelentik, hogy nincs összeférhetetlenségük.