- Acido ipofosforoso Proprietà chimiche, usi, produzione
- Contorno
- Proprietà chimiche
- Utilizza
- Tossicità
- IDENTIFICAZIONE DEI PERICOLI
- Metodo di preparazione
- Metodo di produzione
- Descrizione
- Descrizione
- Proprietà chimiche
- Proprietà fisiche
- Usi
- Definizione
- Preparazione
- Metodi di produzione
- Definizione
- Reazioni
- Descrizione generale
- Aria& Reazioni dell’acqua
- Profilo di reattività
- Pericolo
- Pericolo per la salute
- Pericolo di incendio
- Metodi di purificazione
Acido ipofosforoso Proprietà chimiche, usi, produzione
Contorno
L’acido ipofosforoso è noto anche come “ipofosfito” È un olio incolore o un cristallo di deliquescenza, è un importante prodotto chimico fine. L’uso principale è come agente riducente per la placcatura elettrolitica, fosforico impedisce lo scolorimento delle resine, può anche essere utilizzato nel catalizzatore di reazione di esterificazione, il refrigerante, in particolare per la produzione di ipofosfito di sodio ad alta purezza. Esistono diversi metodi per la preparazione, il metodo industriale comune per la produzione è il metodo della resina a scambio ionico e il metodo di elettrodialisi.
Le proprietà chimiche dell’acido ipofosforico, gli usi, la tossicità e i metodi di produzione sono modificati da andy di Chemicalbook. (2016-12-04)
Proprietà chimiche
Si tratta di cristalli deliquescenti o olio incolore. Punto di fusione: 26.5℃. La densità relativa (peso specifico): 1.439 (solido, 19℃). È solubile in acqua, etanolo ed etere e può essere miscelato in qualsiasi proporzione con acqua, etanolo, acetone. Nell’aria, si deliquesce facilmente a liquido sciropposo e la soluzione acquosa è acida.
L’acido ipofosforico è acido monobasico, in soluzione acquosa, l’acido ipofosforico è acido forte, Ka = 10-2 (25℃); è relativamente stabile a temperatura ambiente; la reazione di sproporzione può procedere a 130℃, decomporsi in fosfina e acido fosforoso:
2H3PO2=H3PO4+PH3
Ha una forte riduzione, la soluzione salina di metalli pesanti può essere ripristinata su metalli come ad esempio:
4Ag + H3PO2 + 2H2)=4Ag + H3PO4 + 4H +
È un ossidante debole, può essere ridotto a fosfina, fosfina quando incontra un forte agente riducente.
Utilizza
1. L’acido ipofosforico è usato come agente riducente per la placcatura elettrolitica;
2. Può essere usato per prevenire lo scolorimento della resina di acido fosforico;
3. È usato come catalizzatore di esterificazione, il refrigerante;
4. È usato per produrre ipofosfito, sali di sodio, sali di manganese, sali di ferro sono generalmente usati come sostanze nutrienti;
5. L’acido ipofosforico è usato in medicina e come agente riducente, la determinazione di arsenico, tellurio e separazione di tantalio, niobio e altri reagenti.
6. È forte agente riducente, può essere utilizzato per la preparazione di ipofosfito di sodio, fosfato di calcio e altri ipofosfiti.
7. Può essere utilizzato per il bagno di placcatura. Farmaceutico. agente riducente. reagenti generali.
8. È un forte agente riducente, può essere utilizzato nella produzione di ipofosfito di sodio, fosfato di calcio e altri ipofosfiti.
9. Questo prodotto è ampiamente usato come agente riducente, Ag, Cu, Ni, Hg e altri metalli sono ridotti al metallo corrispondente, per la verifica di As, Nb, Ta e altri reagenti, può essere utilizzato per la preparazione di Na, K, Ca, Mn, Fe e altri tipi di ipofosfito.
Tossicità
Non è combustibile. Ma quando i contatti con l’agente H foro, causerà il fuoco. Quando incontra l’agente ossidante, la reazione violenta e la combustione possono procedere. Quando viene riscaldato ad alta, può decomporsi in gas fosfina altamente tossico, o addirittura esplodere. È corrosivo. L’acido ipofosforico viene spesso aggiunto nelle bevande analcoliche e perché non viene assorbito. Quindi il rischio è piccolo, ma l’ipofosfito particolarmente forte fa male al tratto gastrointestinale. Accidentalmente spruzzi negli occhi o contatti pelle, molta acqua viene utilizzata per lavato. Gli operatori di produzione devono indossare indumenti protettivi e altri indumenti protettivi. L’attrezzatura di produzione dovrebbe essere sigillata, l’officina dovrebbe essere ventilata bene.
IDENTIFICAZIONE DEI PERICOLI
Indicazione di pericolo:
Provoca gravi ustioni cutanee e lesioni oculari.
Provoca gravi lesioni oculari
Consigli di prudenza:
Non respirare polvere/fumi/gas/nebbia/vapori/spruzzo.
Lavare accuratamente dopo la manipolazione.
Indossare guanti protettivi e proteggere gli occhi/il viso.
IN CASO DI INGESTIONE: Sciacquare la bocca. NON indurre il vomito.
IN CASO DI CONTATTO CON LA PELLE (o con i capelli): Rimuovere/togliere immediatamente tutti gli indumenti contaminati. Risciacquare la pelle con acqua / doccia.
IN CASO DI CONTATTO CON GLI OCCHI: Sciacquare accuratamente con acqua per alcuni minuti. Rimuovere le lenti a contatto, se
presente e facile da fare. Continuare il risciacquo.
IN CASO DI INALAZIONE: portare la vittima all’aria aperta e mantenerla a riposo in una posizione comoda per respirare.
Chiamare immediatamente un CENTRO ANTIVELENI o un medico.
Negozio bloccato.
Smaltire questo materiale e il suo contenitore nel punto di raccolta dei rifiuti pericolosi o speciali.
Metodo di preparazione
1. La soluzione di fosforo e idrossido di bario viene riscaldata, il sale di bario Ba (H2PO2) 2 • 2H2O può generare, l’acido solforico viene aggiunto alla soluzione di bario acido ipofosforico, Ba2+ può precipitare:
Ba(H2PO2)2+H2SO4=BaSO4+2H3PO2
L’acido ipofosforico può essere ottenuto evaporando a pressione ridotta A causa di questo processo, la solubilità del sale di bario è piccola, quindi la concentrazione di acido ipofosforico ottenuto non è elevata, il prodotto industriale deve essere purificato mediante ricristallizzazione.
2. l’ossido di bario (o calce) e la soluzione di fosforo bianco vengono riscaldati insieme per formare fosfato di bario secondario (o calcio), e quindi reagisce con acido solforico, viene filtrato, concentrato per ottenere il prodotto, o la soluzione di ipofosfito di sodio procede La resina a scambio ionico di tipo H può derivare il prodotto. Questo metodo richiede una grande quantità di resina, e la rigenerazione della resina e la fase di lavaggio sono ingombranti, generalmente costa più di 7 7 per libbra, è adatto solo per la produzione di piccoli lotti e non adatto per applicazioni industriali su larga scala.
3. Hypophosphorous acido viene preparato mediante elettrodialisi metodo, in cui il elettrodialisi cellula si divide in tre parti, sono anodo camera, materie prime di camera e catodica, l’intermedio è separato da una membrana anionica e cationica di membrana, tra due membrane di sodio hypophosphite soluzione è posta (concentrazione di 100g/L~500 g/L), camera anodica è soluzione diluita di Hypophosphorous acido 5g/L, camera anodica è diluita di idrossido di sodio in soluzione ( 5g /L), tra i poli DC (3V~36V) è passato, anodo di ossigeno, e genera un prodotto secondario di Hypophosphorous acido; catodo emette idrogeno, e genera un prodotto secondario di idrossido di sodio, il tempo di reazione è di 3~21h. Le reazioni della camera anodica e catodica sono come segue:
camera anodica:
H2O==H + + OH-
2OH-==O2+2H2O+4e
H + + H2PO2-==H3PO2
catodica:
H2O==H + + OH-
2H++2e==H2
Na++OH-==NaOH
Elettrodialisi metodo di preparazione Hypophosphorous acido è semplice e macchinari investimenti è di piccole dimensioni, è adatto per la produzione di massa.
4. A partire dall’ipofosfito di sodio di grado industriale, Cl -, SO42-anioni che influenzano gli indicatori di qualità dell’acido ipofosforico vengono rimossi per precipitazione, gli ioni di metalli pesanti vengono rimossi dalla soluzione formando solfuro e quindi utilizzando una forte resina di scambio cationico acido per ottenere fosfato secondario di sodio, un prodotto di elevata purezza può ottenere. Il processo può produrre fosfato secondario di alta qualità, tecnicamente è fattibile, il processo è semplice, facile da usare, buona qualità del prodotto, può soddisfare le esigenze dell’industria elettronica, dell’industria della difesa e di altri campi high-tech.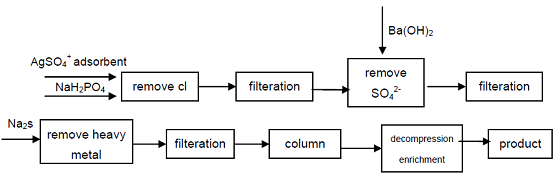
figura 1 Processo di produzione di acido ipofosforico da ipofosfito di sodio industriale.
5. Metodo della resina di scambio ionico: circa 70g di resina di scambio cationico bagnata con acqua è imballato in un tubo di vetro con acido cloridrico 5 mol/L che circola circa 15min, dopo accuratamente lavato con acqua, soluzione acquosa di ipofosfito di sodio acquoso di elevata purezza (15 g / 60 ml H2O) scorre attraverso di esso, la colonna di resina viene L’acido effluente e il lavaggio sono combinati, è concentrato per evaporazione a bagnomaria. L’acido concentrato viene posto in alto vuoto con essiccatore P205 per disidratazione, raffreddamento e cristallizzazione, filtrazione, ricristallizzazione, per ottenere un prodotto acido ipofosforico.
Metodo di produzione
Metodo di resina a scambio ionico: mettere circa 70 g di resine cationiche solubili in acqua per riempire in un tubo di vetro. Far circolare con acido cloridrico 5 mol / L per circa 15 min e lavare sufficientemente con acqua. Far scorrere una soluzione acquosa di ipofosfito di sodio (15 g/60 ml H2O) attraverso la colonna di resina, quindi lavare prima con 50 ml di acqua e quindi risciacquare con 25 rnl di acqua distillata. L’acido effluente e i lavaggi sono stati combinati e concentrati per evaporazione a bagnomaria. L’acido concentrato viene inviato all’essiccatore P205 altamente sottovuoto per la disidratazione, seguito da cristallizzazione, filtrazione e ricristallizzazione per ottenere il prodotto finito di acido ipofosforico.
Descrizione
L’acido ipofosforico è un potente agente riducente con una formula molecolare di H3PO2. I chimici inorganicireferiscono all’acido libero con questo nome sebbene il suo nome IUPAC sia dihydridohydroxidooxidophosphorus, o il nome accettabile dell’acido fosfinico. È un composto incolore a bassa fusione, solubile in acqua,diossano e alcoli. La formula per hypophosphorousacid è generalmente scritta H3PO2, ma una presentazione più descrittiva è HOP(O)H2 che evidenzia il suo carattere monoprotico. Sali derivati da questo acidosi chiamano fosfinati (ipofosfiti).
Descrizione
Questo acido ha la formula generale diH4P2O6 e differisce dagli altri acidi ossifosforici. Ha molti peculiarities.It è formato insieme a fosforo e fosforicoacidi, quando il fosforo viene ossidato dall’aria umida.Se il fosforo bianco è esposto all’aria e l’acetato di sodioè aggiunto al liquidoche si forma, l’ipofosfato di sodio un po ‘ insolubilesodico, Na2H2P2O6·6h2oseparati. L’ipofosfato di sodio monoidrato, tuttavia, è molto solubile e deliquescente a ~98,7 g / 100 ml.
Proprietà chimiche
liquido incolore
Proprietà fisiche
Cristalli deliquescenti incolori o liquido oleoso; odore acido; densità 1,493 g / cm3; si scioglie a 26,5°C; bolle a 130°C; molto solubile in acqua, alcool ed etere; la densità di una soluzione acquosa al 50% è 1,13 g/mL.
Usi
Preparazione di ipofosfiti, bagni galvanici.
Definizione
ChEBI: un ossoacido di fosforo costituito da un singolo fosforo pentavalente legato covalentemente tramite singoli legami a due idrogeni e un gruppo idrossi e tramite un doppio legame a un ossigeno. Il genitore della classe degli acidi fosfinici.
Preparazione
L’acido ipofosforico può essere preparato con vari metodi:
1. Ebollizione fosforo bianco con idrossido di calcio:
P4 + 4Ca(OH)2 + 8H2O → 4Ca(H2PO2)2 + 4H2
Il sale di calcio è solubile in acqua. Il trattamento con acido solforico produce l’acido ipofosforico:
(H2PO2) 2Ca + H2SO4 → 2H3PO2 + CaSO4
La miscela di prodotto viene filtrata per rimuovere il CaSO4 insolubile. La soluzione acquosa dell’acido ipofosforico è concentrata a pressione ridotta.Al posto dell’idrossido di calcio può essere utilizzata acqua concentrata di barita.2. Trattando ipofosfito di sodio, nah2po2con una resina a scambio ionico.Il sale di sodio può essere prodotto facendo bollire il fosforo bianco con una soluzione di idrossido di sodio, una reazione simile a (1) sopra.
PH3 + 2I2 + 2H2O → H3PO2 + 4HI
Il metodo di cui sopra può essere considerato più sicuro di quello che coinvolge riscaldamento biancofosforo con un alcali.
L’acido ipofosforico deve essere conservato sotto i 50°C. Viene venduto commercialmentecome soluzione acquosa a varie concentrazioni.
Metodi di produzione
L’acido ipofosforico è formato dalla reazione di ipofosfito di bario e acido solforico e dal filtraggio del solfato di bario. Per evaporazione della soluzione sotto vuoto a 80 °C, quindi raffreddamento a 0°C, l’acido ipofosforico cristallizza.
Definizione
Un solido cristallino bianco. È un acido monobasico che forma l’anione H2PO2-in acqua. Il sale di sodio, e quindi l’acido, può essere preparato riscaldando il fosforo giallo con una soluzione di idrossido di sodio. L’acido libero e i suoi sali sono potenti agenti riducenti.
Reazioni
L’acido ipofosforico è miscibile con acqua in tutte le proporzioni e una forza commerciale è 30% H3PO2. Gli ipofosfiti sono usati in medicina. L’acido ipofosforoso è un potente agente riducente, ad esempio, con forme di solfato di rame idruro cuproso Cu2H2, precipitato marrone, che evolve il gas idrogeno e lascia il rame al riscaldamento; con nitrato d’argento produce argento finemente diviso; con acido solforoso produce zolfo e un po ‘ di idrogeno solforato; con acido solforico produce acido solforoso, che reagisce come sopra;
Descrizione generale
Liquido oleoso incolore o cristalli deliquescenti con un odore acido. Densità 1.439 g / cm3. Punto di fusione 26,5°C. L’inalazione di vapori irrita o brucia le vie respiratorie. Liquidi e vapori possono irritare o bruciare gli occhi e la pelle.
Aria& Reazioni dell’acqua
Deliquescenti. Solubile in acqua.
Profilo di reattività
L’ACIDO IPOFOSFORICO si decompone quando riscaldato in acido fosforico e fosfina spontaneamente infiammabile. Viene ossidato dall’acido solforico con rilascio di anidride solforosa e zolfo. Reagisce in modo esplosivo con l’ossido di mercurio(II). Reagisce violentemente con il nitrato di mercurio (II). Neutralizza le basi nelle reazioni esotermiche.
Pericolo
Rischio di incendio ed esplosione a contatto con agenti ossidanti.
Pericolo per la salute
TOSSICO; l’inalazione, l’ingestione o il contatto della pelle con il materiale possono causare gravi lesioni o morte. Il contatto con la sostanza fusa può causare gravi ustioni alla pelle e agli occhi. Evitare qualsiasi contatto con la pelle. Gli effetti del contatto o dell’inalazione possono essere ritardati. Il fuoco può produrre gas irritanti, corrosivi e / o tossici. Il deflusso dall’acqua di controllo del fuoco o di diluizione può essere corrosivo e / o tossico e causare inquinamento.
Pericolo di incendio
Non combustibile, la sostanza stessa non brucia ma può decomporsi al riscaldamento per produrre fumi corrosivi e/o tossici. Alcuni sono ossidanti e possono accendere combustibili (legno, carta, olio, abbigliamento, ecc.). Il contatto con i metalli può evolvere gas idrogeno infiammabile. I contenitori possono esplodere quando riscaldati.
Metodi di purificazione
L’acido fosforoso è un comune contaminante dell’acido ipofosforoso commerciale al 50%. Jenkins e Jones hanno purificato questo materiale evaporando circa 600mL in un pallone da 1L a 40o, sotto pressione ridotta (in N2), ad un volume di circa 300mL. Dopo che la soluzione è stata raffreddata, è stata trasferita in una beuta a bocca larga che è stata bloccata e lasciata in un bagno di ghiaccio secco/acetone per diverse ore per congelare (se necessario, con graffi del muro). Quando il pallone è stato poi lasciato a ca 5o per 12ore, circa il 30-40% di esso liquefatto, ed è stato nuovamente filtrato. Questo processo è stato ripetuto, quindi il solido è stato immagazzinato su Mg (ClO4) 2 in un essiccatore sotto vuoto al freddo. Le successive cristallizzazioni da n-butanolo sciogliendolo a temperatura ambiente e poi raffreddandolo in un bagno di sale ghiacciato a-20o non sembravano purificarlo ulteriormente. L’acido libero forma cristalli deliquescenti m 26,5 o ed è solubile in H2O ed EtOH. Il sale NaH2PO2 può essere purificato attraverso una resina a scambio anionico