- Hypofosforig acid chemische eigenschappen, Gebruik, productie
- Outline
- chemische eigenschappen
- gebruikt
- toxiciteit
- identificatie van gevaren
- bereidingsmethode
- productiemethode
- beschrijving
- beschrijving
- chemische eigenschappen
- fysische eigenschappen
- gebruikt
- definitie
- preparaat
- productiemethoden
- definitie
- reacties
- algemene beschrijving
- Lucht & Waterreacties
- Reactiviteitsprofiel
- gevaar
- gevaar voor de gezondheid
- brandgevaar
- zuiveringsmethoden
Hypofosforig acid chemische eigenschappen, Gebruik, productie
Outline
Hypofosforig acid is ook bekend als “hypofosfiet” het is kleurloze olie of deliquescentiekristal , het is een belangrijk fijn chemisch product. Het belangrijkste gebruik is als reductiemiddel voor electroless plating, fosfor voorkomen verkleuring van harsen, het kan ook worden gebruikt in de verestering reactie katalysator, het koelmiddel, in het bijzonder voor de productie van hoge zuiverheid product natriumhypofosfiet. Er zijn verschillende methoden voor de bereiding, de gemeenschappelijke industriële methode voor de productie is ionenwisselingshars methode en elektrodialyse methode.
the chemical properties of hypofosforous acid, uses, toxicity, and production methods zijn edited by andy of Chemicalbook. (2016-12-04)
chemische eigenschappen
het is vervloeiende kristallen of kleurloze olie. Smeltpunt: 26,5℃. De relatieve dichtheid (soortelijk gewicht): 1.439 (vast, 19℃). Het is oplosbaar in water, ethanol en ether, en het kan in om het even welke verhouding met water, ethanol, aceton worden gemengd. In de lucht, het gemakkelijk deliquce naar stroperige vloeistof, en de waterige oplossing is zuur.
Hypofosforig zuur is monobasisch zuur, in waterige oplossing is Hypofosforig zuur sterk zuur, Ka = 10-2 (25℃); Het is relatief stabiel bij kamertemperatuur; disproportionatiereactie kan doorgaan bij 130℃, ontbinden in fosfine en fosforig zuur:
2H3PO2=H3PO4 + PH3
het heeft een sterke reductie, zware metalen zoutoplossing kan worden hersteld tot metalen zoals Cu2+, HG2+, Ag +, zoals:
4Ag + H3PO2+2H2)=4Ag+H3PO4+4H+
het is een zwakke oxidator, het kan worden gereduceerd tot fosfine, fosfine wanneer het een sterk reductiemiddel tegenkomt.
gebruikt
1. Hypofosforigzuur wordt gebruikt als reductiemiddel voor het elektroloos plateren;
2. Het kan worden gebruikt om verkleuring van fosforzuurhars te voorkomen;
3. Het wordt gebruikt als veresteringskatalysator, het koelmiddel;
4. Het wordt gebruikt om hypofosfiet te produceren, natriumzouten, mangaanzouten, ijzerzouten worden over het algemeen gebruikt als voedende stoffen;
5. Hypofosforig zuur wordt gebruikt in de geneeskunde en als reductiemiddel, de bepaling van arseen, tellurium en scheiding van tantaal, niobium en andere reagentia.
6. Het is sterk reductiemiddel, het kan worden gebruikt voor de bereiding van natriumhypofosfiet, calciumfosfaat en andere hypofosfiet.
7. Het kan worden gebruikt voor het plating bad. Geneesmiddelen. reductiemiddel. algemene reagentia.
8. Het is sterk reductiemiddel, het kan worden gebruikt bij het maken van natriumhypofosfiet, calciumfosfaat en andere hypofosfiet.
9. Dit product wordt veel gebruikt als reductiemiddel, Ag, Cu, Ni, Hg en andere metalen worden gereduceerd tot het overeenkomstige metaal, voor de verificatie van As, Nb, Ta en andere reagentia, kan het worden gebruikt voor de bereiding van Na, K, Ca, Mn, Fe en andere soorten hypofosfiet.
toxiciteit
het is onbrandbaar. Maar bij contacten met de hole H agent, zal het brand veroorzaken. Wanneer ontmoet oxiderende agent, gewelddadige reactie en verbranding kan doorgaan. Wanneer het wordt verhit tot hoog, kan het ontleden in zeer giftig fosfinegas, of zelfs exploderen. Het is corrosief. Hypofosforig zuur wordt vaak toegevoegd aan frisdranken, en omdat het niet wordt opgenomen. Dus het risico is klein, maar bijzonder sterke hypofosfiet pijn gastro-intestinale. Per ongeluk spat het in de ogen of contact met de huid, veel water wordt gebruikt om gewassen. Productiemedewerkers dienen beschermende kleding en andere beschermende kleding te dragen. Het productiemateriaal zou moeten worden verzegeld, zou de workshop goed moeten worden geventileerd.
identificatie van gevaren
gevarenaanduiding:
Veroorzaakt ernstige brandwonden van de huid en oogschade.
Veroorzaakt ernstige oogschade
voorzorgsmaatregelen:
geen stof/rook/gas/nevel/dampen/spray inademen.
was grondig na hantering.
Draag beschermende handschoenen en oog – / gezichtsbescherming.
bij inslikken: Mond spoelen. Niet braken opwekken.
indien op huid (of haar): verwijder/trek onmiddellijk alle verontreinigde kleding uit. Spoel de huid met water / douche.
in de ogen: voorzichtig spoelen met water gedurende enkele minuten. Verwijder contactlenzen, indien
aanwezig en gemakkelijk te gebruiken. Blijf spoelen.
bij inademing: breng het slachtoffer in de frisse lucht en houd het in rust in een comfortabele adempositie.
bel onmiddellijk een antigifcentrum of Arts/Arts.
opslag afgesloten.
verwijder dit materiaal en de container naar het inzamelpunt voor gevaarlijk of speciaal afval.
bereidingsmethode
1. Fosfor en bariumhydroxideoplossing worden verhit, bariumzout Ba(H2PO2) 2 • 2H2O kan produceren, zwavelzuur wordt toegevoegd aan hypofosforig zuur bariumoplossing, Ba2+ kan neerslaan:
Ba (H2PO2)2+H2SO4=BaSO4+2H3PO2
Hypofosforigzuur kan worden verkregen door verdamping onder verminderde druk en kristallisatie bij lage temperatuur. Vanwege in dit proces is de oplosbaarheid van het bariumzout klein, dus de concentratie van verkregen Hypofosforig zuur is niet hoog, industrieel product moet worden gezuiverd door herkristallisatie.
2. de bariumoxide (of kalk) en oplossing van witte fosfor wordt samen verwarmd om secundair bariumfosfaat (of calcium) te vormen, en reageert vervolgens met zwavelzuur, wordt gefilterd, geconcentreerd om product te verkrijgen, of natriumhypofosfiet oplossing opbrengst H-type ionenwisselingshars kan product afleiden. Deze methode vereist een grote hoeveelheid hars en harsregeneratie en wasstap is omslachtig, het kost over het algemeen meer dan $ 7 per pond, het is alleen geschikt voor kleine batchproductie en niet geschikt voor grootschalige industriële toepassingen.
3. Hypofosforig zuur wordt bereid door elektrodialyse methode, waarbij de elektrodialyse cel verdeelt in drie delen, ze zijn anode kamer, grondstof kamer en kathode kamer, het tussenproduct wordt gescheiden door anionisch membraan en kationisch membraan, tussen twee membranen natrium hypofosfiet oplossing wordt geplaatst (concentratie van 100g/L~500g/L), anode kamer is verdunde oplossing van Hypofosforig zuur 5g/L, anode kamer is verdunde natriumhydroxide oplossing ( 5g /L), tussen de Polen DC (3V~36V) wordt doorgegeven, anode geeft zuurstof af en genereert secundair product van hypofosforig zuur; de reactietijd van de anodekamer en de kathodekamer is als volgt:
anodekamer:
H2O==H++OH-
2OH-==O2+2H2O+4e
h++H2PO2-==H3PO2
kathodekamer:
H2O==H++OH-
2H++2e==H2
na++oh-==NaOH
elektrodialyse bereidingswijze hypofosforig zuur is eenvoudig en de investering in apparatuur is klein, het is geschikt voor massaproductie.
4. Uitgaande van de industriële rang natriumhypofosfiet, CL-, SO42-anionen die de kwaliteitsindicatoren van Hypofosforig zuur beïnvloeden worden verwijderd door precipitatie, worden zware metaalionen uit de oplossing verwijderd door sulfide te vormen en vervolgens sterke zure kationenuitwisselingshars te gebruiken om natrium secundair fosfaat te verkrijgen, kan een hoogzuiver kwaliteitsproduct verkrijgen. Het proces kan hoogwaardig secundair fosfaat produceren, technisch haalbaar is, het proces is eenvoudig, eenvoudige bediening, goede productkwaliteit, Het kan voldoen aan de behoeften van de elektronica-industrie, defensie-industrie en andere high-tech gebieden.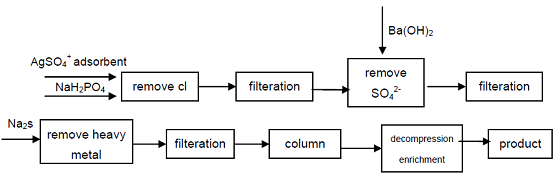
figuur 1 productieproces van Hypofosforig zuur uit industrieel Natriumhypofosfiet.
5. Ionenwisselingshars methode: ongeveer 70 g kationwisselingshars bevochtigd met water wordt verpakt in een glazen buis met 5 mol/l zoutzuur circulerende ongeveer 15min, na grondig gewassen met water, hoge zuiverheid waterige natriumhypofosfiet waterige oplossing (15 g/60 ml H2O) stroomt door het, wordt de harskolom eerst gewassen met 50 ml, dan met 25 RNL gedestilleerd water. Het effluent zuur en wassen wordt gecombineerd, het wordt geconcentreerd door verdamping in waterbad. Het geconcentreerde zuur wordt in hoog vacuüm geplaatst met P205 droger voor uitdroging, koeling en kristallisatie, filtratie, herkristallisatie, om hypofosforig zuur product te verkrijgen.
productiemethode
Ionenwisselharsmethode: vul ongeveer 70 g in water oplosbare kationenwisselharsen in een glazen buis. Circuleer ongeveer 15 minuten met zoutzuur 5 mol/L en was voldoende met water. Laat een hoogwaterige natriumhypofosfietoplossing (15 g/60 ml H2O) door de harskolom stromen, gevolgd door eerst te wassen met 50 ml water en vervolgens te spoelen met 25 RNL gedestilleerd water. Het effluentzuur en de spoeling werden gecombineerd en geconcentreerd door verdamping op een waterbad. Het geconcentreerde zuur wordt naar de zeer vacuüm, P205 droger voor uitdroging, gevolgd door het koelen kristallisatie, filtratie en herkristallisatie om het eindproduct van hypofosforig zuur te verkrijgen.
beschrijving
Hypofosforig zuur is een krachtig reducerend middel met een moleculaire formule van H3PO2. Anorganische chemici verwijzen naar het vrije zuur met deze naam, hoewel de Iupacnaam dihydridohydroxidooxidophosphorus is, of de aanvaardbare naam van fosfinezuur. Het is een kleurloos smeltende verbinding, die oplosbaar is in water,dioxaan en alcoholen. De formule voor hypofosforouszuur wordt meestal geschreven h3po2, maar een meer beschrijvende presentatie is HOP (O)H2 die zijn monoprotische karakter benadrukt. Zouten afgeleid van deze acidare fosfinaten (hypofosfieten) genoemd.
beschrijving
dit zuur heeft de algemene formule h4p2o6 en verschilt van de andere oxyfosforzuren. Het heeft veel peculiarities.It wordt gevormd samen met fosfor en fosforicaciden, wanneer fosfor wordt geoxideerd door vochtige lucht.Als witte fosfor wordt blootgesteld aan lucht, en natriumacetaat wordt toegevoegd aan de vloeistof die vormt, scheidt het enigszins onoplosbare natriumhypofosfaat,Na2H2P2O6·6H2. Het natriumhypofosfaatmonohydraat is echter zeer oplosbaar en vervloeiend bij ~98,7 g / 100 ml.
chemische eigenschappen
kleurloze vloeistof
fysische eigenschappen
kleurloze vervloeiende kristallen of olieachtige vloeistof; zure geur; dichtheid 1,493 g / cm3; smelt bij 26,5°C; kookt bij 130°C; zeer oplosbaar in water, alcohol en ether; de dichtheid van een 50%-oplossing in water is 1,13 g/mL.
gebruikt
bereiding van hypofosfieten, galvaniseerbaden.
definitie
ChEBI: een fosforoxozuur dat bestaat uit een enkele pentavalente fosfor die covalent wordt gebonden via enkelvoudige bindingen met twee waterstofgenen en een hydroxygroep en via een dubbele binding met een zuurstof. De moederstof van de klasse van fosfinezuren.
preparaat
Hypofosforigzuur kan met verschillende methoden worden bereid:
1. Kokend Wit fosfor met calciumhydroxide:
P4 + 4Ca(OH)2 + 8H2O → 4Ca (H2PO2)2 + 4H2
het calciumzout is oplosbaar in water. Behandeling met zwavelzuur levert hethypofosforzuur:
(H2PO2)2Ca + H2SO4 → 2H3PO2 + CaSO4
het productmengsel wordt gefilterd om onoplosbaar CaSO4 te verwijderen. De waterige oplossing van hypofosforig zuur wordt geconcentreerd onder verminderde druk.Geconcentreerd baryta-water mag worden gebruikt in plaats van calciumhydroxide.2. Door natriumhypofosfiet, Nah2po2 te behandelen met een ionenuitwisselingshars.Het natriumzout kan worden geproduceerd door witte fosfor te koken met een oplossing van natriumhydroxide, een reactie die vergelijkbaar is met (1) hierboven.
PH3 + 2I2 + 2H2O → H3PO2 + 4HI
bovenstaande methode kan als veiliger worden beschouwd dan die waarbij de witte fosfor met een alkali wordt verhit.
Hypofosforig zuur moet worden bewaard beneden 50°C. Het wordt in de handel verkocht als een waterige oplossing in verschillende concentraties.
productiemethoden
Hypofosforig zuur wordt gevormd door reactie van bariumhypofosfiet en zwavelzuur en filtert bariumsulfaat af. Door verdamping van de oplossing in vacuüm bij 80 °C en vervolgens afkoeling tot 0°C kristalliseert hypofosforig zuur.
definitie
een witte kristallijne vaste stof. Het is een monobasisch zuur dat het anion H2PO2 – in water vormt. Het natriumzout, en dus het zuur, kan worden bereid door gele fosfor met natriumhydroxideoplossing te verhitten. Het vrije zuur en zijn zouten zijn krachtige reducerende middelen.
reacties
Hypofosforig zuur is mengbaar met water in alle verhoudingen en een commerciële sterkte is 30% H3PO2. Hypofosfieten worden gebruikt in de geneeskunde. Hypofosforig zuur is een krachtig reductiemiddel, bijvoorbeeld, met kopersulfaat vormt cupro hydride Cu2H2, bruin neerslag, die waterstofgas evolueert en laat koper op opwarming; met zilvernitraat geeft fijn verdeeld zilver; met zwavelzuur geeft zwavel en wat waterstofsulfide; met zwavelzuur geeft zwavelzuur, dat reageert als hierboven; vormt mangaanachtig onmiddellijk met permanganaat.
algemene beschrijving
kleurloze olieachtige vloeibare of vervloeiende kristallen met een zure geur. Dichtheid 1,439 g / cm3. Smeltpunt 26,5°C. inademing van dampen irriteert of verbrandt de luchtwegen. Vloeistof en dampen kunnen ogen en huid irriteren of verbranden.
Lucht & Waterreacties
Deliquescent. In Water oplosbaar.
Reactiviteitsprofiel
HYPOFOSFORIG zuur ontleedt bij verhitting tot fosforzuur en spontaan ontvlambaar fosfine. Wordt geoxideerd door zwavelzuur met afgifte van zwaveldioxide en zwavel. Reageert explosief met kwik(II) oxide . Reageert heftig met kwik(II) nitraat . Neutraliseert basen in exotherme reacties.
gevaar
Brand – en explosierisico bij contact met oxiderende stoffen.
gevaar voor de gezondheid
vergiftig; inademing, inslikken of huidcontact met het materiaal kan ernstig letsel of de dood veroorzaken. Contact met gesmolten stof kan ernstige brandwonden op huid en ogen veroorzaken. Vermijd huidcontact. Effecten van contact of inademing kunnen vertraagd zijn. Brand kan irriterende, corrosieve en/of giftige gassen produceren. Afvoer uit brandbestrijdings – of verdunningswater kan corrosief en/of toxisch zijn en verontreiniging veroorzaken.
brandgevaar
onbrandbaar; de stof zelf verbrandt niet, maar kan bij verhitting ontleden tot bijtende en/of giftige dampen. Sommige zijn oxidatiemiddelen en kunnen brandbare stoffen (hout, papier, olie, kleding, enz.). Contact met metalen kan ontvlambaar waterstofgas ontwikkelen. Containers kunnen exploderen bij verhitting.
zuiveringsmethoden
Fosforig zuur is een veel voorkomende verontreiniging van commercieel 50% hypofosforig zuur. Jenkins en Jones gezuiverd dit materiaal door verdampen ongeveer 600mL in een 1L kolf bij 40o, onder verminderde druk (in N2), tot een volume van ongeveer 300mL. Nadat de oplossing was afgekoeld, werd deze overgebracht naar een Erlenmeyer met brede bek, die werd gestopt en gedurende enkele uren in een Droogijsbad/acetonbad werd gelaten om te bevriezen (zo nodig met krassen aan de wand). Toen de kolf 12 uur bij ca 5o werd gelaten, werd ongeveer 30-40% vloeibaar en werd opnieuw gefilterd. Dit proces werd herhaald, vervolgens werd de vaste stof opgeslagen boven Mg (ClO4)2 in een vacuüm exsiccator in de koude. Latere kristallisaties uit n-butanol door het op kamertemperatuur op te lossen en vervolgens af te koelen in een ijszoutbad op-20o bleken het niet verder te zuiveren. Het vrije zuur vormt deliquescent kristallen m 26.5 o en is oplosbaar in H2O en EtOH. Het nah2po2 zout kan worden gezuiverd via een anionenwisselingshars