- acid Hipofosforic proprietăți chimice, utilizări,producție
- contur
- proprietăți chimice
- utilizări
- toxicitate
- identificarea pericolelor
- metoda de preparare
- metoda de producție
- descriere
- descriere
- proprietăți chimice
- proprietăți fizice
- utilizează
- definiție
- preparat
- metode de producție
- definiție
- reacții
- descriere generală
- Aer & Reacții De Apă
- profil de reactivitate
- pericol
- pericol pentru sănătate
- pericol de incendiu
- metode de purificare
acid Hipofosforic proprietăți chimice, utilizări,producție
contur
acidul Hipofosforic este , de asemenea, cunoscut sub numele de „hipofosfit” este ulei incolor sau cristal de deliquescență, este un produs chimic fin important. Utilizarea principală este ca agent reducător pentru placarea fără electroliți, fosforul previne decolorarea rășinilor, poate fi utilizat și în catalizatorul de reacție de esterificare, agentul frigorific, în special pentru producerea de hipofosfit de sodiu produs de înaltă puritate. Există mai multe metode de preparare, metoda industrială comună pentru producerea este metoda rășinii schimbătoare de ioni și metoda electrodializei.
proprietățile chimice ale acidului hipofosforic, utilizările, toxicitatea și metodele de producție sunt editate de andy De La Chemicalbook. (2016-12-04)
proprietăți chimice
este cristale delicvescente sau ulei incolor. Punct de topire: 26.5. Densitatea relativă( greutate specifică): 1.439 (solid, 19 inqut). Este solubil în apă, etanol și eter și poate fi amestecat în orice proporție cu apă, etanol, acetonă. În aer, se deliquesce cu ușurință la lichid siropos, iar soluția apoasă este acidă.
acidul Hipofosforos este acid monobazic, în soluție apoasă, acidul Hipofosforos este acid puternic, Ka = 10-2( 25%); este relativ stabil la temperatura camerei; reacția de disproporționare poate continua la 130%, se poate descompune în fosfină și acid fosforos:
2h3po2 = H3PO4 + PH3
are o reducere puternică, soluția de sare a metalelor grele poate fi ca:
4Ag + H3PO2 + 2H2)=4AG+H3PO4+4H+
este oxidant slab, poate fi redus la fosfină, fosfină atunci când întâlnește un agent reducător puternic.
utilizări
1. Acidul hipofosforic este utilizat ca agent reducător pentru placarea fără electroliți;
2. Poate fi folosit pentru a preveni decolorarea rășinii acidului fosforic;
3. Este folosit ca catalizator de esterificare, agentul frigorific;
4. Este utilizat pentru a produce hipofosfit, săruri de sodiu, săruri de mangan, sărurile de fier sunt utilizate în general ca substanțe nutritive;
5. Acidul hipofosforic este utilizat în medicină și ca agent reducător, determinarea arsenicului, telurului și separarea tantalului, niobiului și a altor reactivi.
6. Este un agent reducător puternic, poate fi utilizat pentru prepararea hipofosfitului de sodiu, a fosfatului de calciu și a altor hipofosfite.
7. Poate fi folosit pentru baia de placare. Farmaceutice. agent de reducere. reactivi generali.
8. Este un agent reducător puternic, poate fi utilizat în fabricarea hipofosfitului de sodiu, a fosfatului de calciu și a altor hipofosfite.
9. Acest produs este utilizat pe scară largă ca agent reducător, Ag, Cu, Ni, Hg și alte metale sunt reduse la metalul corespunzător, pentru verificarea As, NB, Ta și a altor reactivi, poate fi utilizat pentru prepararea Na, K, Ca, Mn, Fe și alte tipuri de hipofosfit.
toxicitate
este incombustibil. Dar atunci când contactele cu agentul h gaura, aceasta va provoca foc. Când întâlnește agent oxidant, reacție violentă și de ardere poate continua. Când este încălzit la mare, se poate descompune în gaz fosfinic foarte toxic sau chiar poate exploda. Este coroziv. Acidul hipofosforos este adesea adăugat în băuturile răcoritoare și pentru că nu este absorbit. Deci, riscul este mic, dar hipofosfit deosebit de puternic rănit gastro-intestinale. Accidental se stropește în ochi sau contactează pielea, se spală multă apă. Operatorii de producție trebuie să poarte îmbrăcăminte de protecție și alte îmbrăcăminte de protecție. Echipamentele de producție trebuie sigilate, atelierul trebuie ventilat bine.
identificarea pericolelor
frază de pericol:
provoacă arsuri grave ale pielii și leziuni oculare.
Provoacă leziuni oculare grave
fraze de precauție:
nu respirați praful/fumul/gazul/ceața/vaporii / spray-ul.
spălați bine după manipulare.
purtați mănuși de protecție și protecție pentru ochi/față.
în caz de înghițire: Clătiți gura. Nu provocați vărsături.
în caz de contact cu pielea( sau părul): îndepărtați/scoateți imediat toate hainele contaminate. Clătiți pielea cu apă / duș.
în caz de contact cu ochii: Clătiți cu atenție cu apă timp de câteva minute. Scoateți lentilele de contact, dacă
sunt prezente și ușor de făcut. Continuați să clătiți.
în caz de inhalare: scoateți victima la aer curat și mențineți-o în repaus într-o poziție confortabilă pentru respirație.
sunați imediat la un centru de informare toxicologică sau la un medic.
magazin închis.
aruncați acest material și recipientul său la un punct de colectare a deșeurilor periculoase sau speciale.
metoda de preparare
1. Fosfor și soluție de hidroxid de bariu este încălzit, ba sare de bariu (H2PO2)2 * 2H2O poate genera, acid sulfuric se adaugă în soluție de bariu acid hipofosforic, Ba2+ poate precipita:
Ba(H2PO2) 2+H2SO4=BaSO4+2h3po2
acid Hipofosforic poate fi obținut prin evaporarea sub presiune redusă și cristalizare la temperatură scăzută. Datorită acestui proces, solubilitatea sării de bariu este mică, astfel încât concentrația acidului Hipofosforic obținut nu este mare, produsul industrial trebuie purificat prin recristalizare.
2. oxidul de bariu (sau varul) și soluția de fosfor alb sunt încălzite împreună pentru a forma fosfat secundar de bariu (sau calciu) și apoi reacționează cu acidul sulfuric, este filtrat, concentrat pentru a obține produsul sau soluția de hipofosfit de sodiu continuă rășina schimbătoare de ioni de tip H poate deriva produs. Această metodă necesită o cantitate mare de rășină, iar regenerarea rășinii și etapa de spălare sunt greoaie, în general costă mai mult de 7 USD pe kilogram, este potrivită doar pentru producția de loturi mici și nu este potrivită pentru aplicații industriale la scară largă.
3. Acidul hipofosfor este preparat prin metoda electrodializei, în care celula de electrodializă se împarte în trei părți, acestea sunt camera anodică, camera materiei prime și camera catodică, intermediarul este separat de membrana anionică și membrana cationică, între două membrane se plasează soluția de hipofosfit de sodiu (concentrație de 100g/l~500g/L), camera anodică este soluția diluată de acid Hipofosforic 5g/L, camera anodică este soluția diluată de hidroxid de sodiu ( 5g /L), între poli DC (3V~36V) trecut, anod eliberează oxigen, și generează produs secundar de acid hipofosforic; catodul emite hidrogen și generează produs secundar de hidroxid de sodiu, timpul de reacție este de 3~21h. reacțiile camerei anodice și ale camerei catodice sunt după cum urmează:
camera anodică:
H2O==H++OH-
2OH-==O2+2H2O+4e
H++H2PO2-==h3po2
camera catodică:
H2O==-
2h++2e==H2
na++Oh-==NaOH
metoda de preparare a electrodializei acidul hipofosforic este simplu, iar investiția în echipamente este mică, este potrivită pentru producția în masă.
4. Pornind de la hipofosfit de sodiu de calitate industrială, anionii Cl -, SO42-care afectează indicatorii de calitate ai acidului Hipofosforos sunt îndepărtați prin precipitare, ionii de metale grele sunt îndepărtați din soluție prin formarea sulfurii și apoi folosind rășină schimbătoare de cationi acizi puternici pentru a obține fosfat secundar de sodiu, se poate obține un produs de înaltă puritate. Procesul poate produce fosfat secundar de înaltă calitate, din punct de vedere tehnic este fezabil, procesul este simplu, operare ușoară, calitate bună a produsului, poate satisface nevoile industriei electronice, industriei de apărare și a altor domenii de înaltă tehnologie.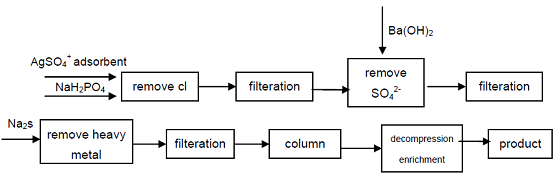
figura 1 Procesul de producție a acidului Hipofosforos din Hipofosfit de sodiu Industrial.
5. Metoda rășinii schimbătoare de ioni: aproximativ 70 g de rășină schimbătoare de cationi umezită cu apă este ambalată într-un tub de sticlă cu 5 mol/L acid clorhidric care circulă aproximativ 15min, după spălarea temeinică cu apă, curge prin ea soluție apoasă de hipofosfit de sodiu de înaltă puritate (15 g/60 ml H2O), coloana de rășină este mai întâi spălată cu 50 ml, apoi cu 25 RNL apă distilată. Acidul efluent și spălarea sunt combinate, se concentrează prin evaporare în baia de apă. Acidul concentrat este plasat în vid înalt cu uscător P205 pentru deshidratare, răcire și cristalizare, filtrare, recristalizare, pentru a obține produs acid hipofosforic.
metoda de producție
metoda rășinii schimbătoare de ioni: puneți aproximativ 70 g rășini schimbătoare de cationi solubili în apă pentru a umple într-un tub de sticlă. Circulați cu 5 mol/L acid clorhidric timp de aproximativ 15 min și spălați suficient cu apă. Aveți o soluție apoasă de hipofosfit de sodiu ridicat (15 g/60 ml H2O) pentru a curge prin coloana de rășină, urmată de spălarea mai întâi cu 50 ml apă și apoi clătirea cu 25 RNL apă distilată. Acidul efluent și spălările au fost combinate și concentrate prin evaporare pe o baie de apă. Acidul concentrat este trimis la uscătorul foarte vid, P205 pentru deshidratare, urmat de cristalizarea, filtrarea și recristalizarea răcirii pentru a obține produsul finit al acidului hipofosforic.
descriere
acidul Hipofosforic este un agent reducător puterniccu o formulă moleculară de H3PO2. Chimiștii anorganici se referă la acidul liber cu acest nume, deși numele său IUPAC este dihidridohidroxidooxidofosfor, sau denumirea acceptabilă a acidului fosfinic. Este incolor. compus cu topire scăzută,care este solubil în apă, dioxan și alcooli. Formula pentru hipofosforacid este în general scrisă H3PO2, dar o prezentare mai descriptivă este HOP(O)H2 care evidențiazăcaracterul său monoprotic. Săruri derivate din acest acidse numesc fosfinați (hipofosfiți).
descriere
acest acid are formula generală de h4p2o6 și diferă de ceilalți acizi oxifosforici. Ea are multe peculiarities.It se formează împreună cu fosforul și fosforulacizi, când fosforul este oxidat de aerul umed.Dacă fosforul alb este expus la aer și acetatul de sodiueste adăugatla lichidcare se formează, hipofosfatul de sodiu oarecum insolubil,Na2H2P2O6·6h2oseparat. Cu toate acestea, hipofosfatul de sodiu monohidrat este foartesolubil și delicvescent la 98,7 g/100 ml.
proprietăți chimice
lichid incolor
proprietăți fizice
cristale delicvescente incolore sau lichid uleios; miros acru; densitate 1,493 g/cm3;se topește la 26,5 CTC; fierbe la 130 CTC; foarte solubil în apă, alcool și eter; densitatea unei soluții apoase 50% este de 1,13 g/mL.
utilizează
prepararea hipofosfiților, electroplatingbaths.
definiție
ChEBI: un oxoacid de fosfor care constă dintr-un singur fosfor pentavalent legat covalent prin legături simple la doi hidrogeni și o grupare hidroxi și printr-o legătură dublă la un oxigen. Părintele clasei de acizi fosfinici.
preparat
acidul Hipofosforic poate fi preparat prin diferite metode:
1. Fierberea fosforului alb cu hidroxid de calciu:
P4 + 4CA(OH)2 + 8h2o 4CA(H2PO2)2 + 4H2
sarea de calciu este solubilă în apă. Tratamentul cu acid sulfuric produce acid hipofosforic:
(H2PO2)2CA + H2SO4 2H3PO2 + CaSO4
amestecul de produse este filtrat pentru a elimina CaSO4 insolubil. Soluția apoasă a acidului hipofosforic este concentrată sub presiune redusă.Apa Baryta concentrată poate fi utilizată în locul hidroxidului de calciu.2. Prin tratarea hipofosfitului de sodiu, Nah2po2cu o rășină schimbătoare de ioni.Sarea de sodiu poate fi produsă prin fierberea fosforului alb cu o soluție de hidroxid de sodiu, o reacție similară cu (1) de mai sus.
PH3 + 2I2 + 2H2O H3PO2 + 4HI
metoda de mai sus poate fi considerată mai sigură decât cea care implică încălzirea fosforului alb cu un alcalin.
acidul Hipofosforic trebuie depozitat sub 50 de centimetrii C. Se vinde comercialca soluție apoasă la diferite concentrații.
metode de producție
acidul Hipofosforic se formează prin reacția hipofosfitului de bariu și a acidului sulfuric și prin filtrarea sulfatului de bariu. Prin evaporarea soluției în vid la 80 centi C și apoi răcirea la 0 centi C, acidul hipofosforic cristalizează.
definiție
un solid cristalin alb. Este un acid monobazic care formează anionul H2PO2-în apă. Sarea de sodiu și, prin urmare, acidul, pot fi preparate prin încălzirea fosforului galben cu soluție de hidroxid de sodiu. Acidul liber și sărurile sale sunt agenți reducători puternici.
reacții
acidul Hipofosforic este miscibil cu apa în toate proporțiile și o concentrație comercială este de 30% H3PO2. Hipofosfiții sunt utilizați în medicină. Acidul hipofosforos este un agent reducător puternic, de exemplu, cu sulfat de cupru formează hidrură cuproasă Cu2H2, precipitat maro, care evoluează hidrogen gazos și lasă cuprul la încălzire; cu azotat de argint produce argint fin împărțit; cu acid sulfuros produce sulf și unele hidrogen sulfurat; cu acid sulfuric produce acid sulfuros, care reacționează ca mai sus; formează manganos imediat cu permanganat.
descriere generală
cristale lichide uleioase incolore sau delicvescente cu miros acru. Densitate 1.439 g / cm3. Punctul de topire 26,5 centimetric C. inhalarea vaporilor irită sau arde tractul respirator. Lichidul și vaporii pot irita sau arde ochii și pielea.
Aer & Reacții De Apă
Delicvescent. Solubil în apă.
profil de reactivitate
acidul HIPOFOSFORIC se descompune atunci când este încălzit în acid fosforic și fosfină inflamabilă spontan. Este oxidat de acid sulfuric cu eliberare de dioxid de sulf și sulf. Reacționează exploziv cu oxidul de mercur (II). Reacționează violent cu nitratul de mercur (II). Neutralizează bazele în reacțiile exoterme.
pericol
risc de incendiu și explozie în contact cu agenții oxidanți.
pericol pentru sănătate
TOXIC; inhalarea, ingestia sau contactul pielii cu materialul poate provoca vătămări grave sau deces. Contactul cu substanța topită poate provoca arsuri grave ale pielii și ochilor. Evitați orice contact cu pielea. Efectele contactului sau inhalării pot fi întârziate. Focul poate produce gaze iritante, corozive și / sau toxice. Scurgerile de la controlul incendiului sau apa de diluare pot fi corozive și / sau toxice și pot cauza poluare.
pericol de incendiu
incombustibil, substanța în sine nu arde, dar se poate descompune la încălzire pentru a produce vapori corozivi și/sau toxici. Unele sunt oxidanți și pot aprinde combustibili (lemn, hârtie, ulei, îmbrăcăminte etc.). Contactul cu metalele poate evolua hidrogen gazos inflamabil. Containerele pot exploda atunci când sunt încălzite.
metode de purificare
acidul fosforic este un contaminant comun al acidului hipofosforic comercial de 50%. Jenkins și Jones au purificat acest material prin evaporarea a aproximativ 600 ml într-un balon de 1l la 40o, sub presiune redusă (în N2), la un volum de aproximativ 300 ml. După ce soluția a fost răcită, a fost transferată într-un balon Erlenmeyer cu gură largă, care a fost oprit și lăsat într-o baie de gheață uscată/acetonă timp de câteva ore pentru a îngheța (dacă este necesar, cu zgârierea peretelui). Când balonul a fost apoi lăsat la ca 5o timp de 12ore, aproximativ 30-40% din acesta a fost lichefiat și a fost din nou filtrat. Acest proces a fost repetat, apoi solidul a fost depozitat peste Mg(ClO4)2 într-un desicator de vid la rece. Cristalizările ulterioare din n-butanol prin dizolvarea acestuia la temperatura camerei și apoi răcirea într-o baie cu sare de gheață la-20o nu par să o purifice în continuare. Acidul liber formează cristale delicvescente m 26,5 o și este solubil în H2O și EtOH. Sarea NaH2PO2 poate fi purificată printr-o rășină schimbătoare de anioni