făcând inelul aromatic disponibil pentru atac de nucleofili
majoritatea preparatelor de compuși aromatici pe care le-am văzut (cum ar fi substituția aromatică electrofilă, precum și reacția Suzuki acoperită în secțiunea anterioară) implică inelul aromatic ca nucleofil, reacționând cu un reactiv electrofil. Substituție aromatică nucleofilă (în 17.1.) implică reactivi nucleofili, dar este limitat la inele cu grupuri puternice de retragere a electronilor ortho sau para la un grup care pleacă. Cel mai versatil mod de a face disponibile inele aromatice pentru atacul nucleofil este de a prepara săruri de arendiazoniu, care conțin ionul ArN2+. Diagrama de mai jos prezintă varietatea reacțiilor posibile cu sărurile de arendiazoniu.

sărurile de Arendiazoniu sunt ușor preparate din arilamine (aniline) folosind un proces numit diazotizare. Procesul implică dizolvarea aminei într-un acid adecvat, răcirea într-o baie de gheață la 0-5 oC, apoi adăugarea soluției de nitrit de sodiu (NaNO2). Acidul reacționează cu NaNO2 pentru a forma acid azotic (HNO2), care apoi reacționează cu arilamina pentru a forma sarea de arendiazoniu. Cea mai obișnuită sare de utilizat pentru aceste reacții este clorura (făcută folosind HCl ca acid), care sunt destul de solubile, dar se descompun rapid la temperatura camerei. Cu toate acestea, în unele reacții (cum ar fi formarea fenolului) ionul clorurat poate interfera și înlocui un Cl, deci în aceste cazuri se utilizează sulfatul (realizat folosind H2SO4). Sulfații de diazoniu sunt puțin mai stabili decât clorurile, dar sunt, de asemenea, în general mai puțin solubili și, prin urmare, mai incomod de utilizat. Tetrafluoroborații de diazoniu sunt obținuți din cloruri prin adăugarea HBF4; ele sunt de obicei complet insolubile, ceea ce le permite să fie filtrate, apoi uscate pentru descompunere fără apă prezentă pentru a introduce un fluor pe inel. Această metodă de introducere a fluorului pe un inel aromatic se numește reacția Balz-Schiemann.
sărurile de Arendiazoniu sunt intermediari utili și pierd cu ușurință azotul reacționează cu o varietate de nucleofili, așa cum se arată în diagrama de mai sus. Deoarece azotul este foarte stabil și se pierde ca gaz, acest lucru oferă o forță motrice puternică pentru ca aceste reacții să apară. În cazul ionului de apă sau iodură, nucleofilul reacționează fără a fi nevoie de nicio cataliză. Cu toate acestea, multe reacții ale sărurilor de diazoniu sunt catalizate de cupru(I), caz în care reacția este denumită reacție Sandmeyer.
o reacție care reține cei doi nitrogeni implică cuplarea la un alt inel aromatic (bogat în electroni), așa cum se arată în partea stângă a schemei de reacție. Acest lucru este foarte important în industria coloranților artificiali, care a fost stabilită în principal folosind producția acestor „coloranți azoici” după descoperirea movului lui Perkin în 1856.
utilizarea în sinteză
chimia sării de diazoniu, bazată pe reactivi nucleofili utilizați cu un inel aromatic electrofil, este complementară substituției aromatice electrofile (EAS, care utilizează reactivi electrofili). Sărurile de diazoniu sunt ușor preparate din aromatice printr-o sinteză în trei etape:

dacă sunt necesari alți substituenți, aceștia pot fi introduși în timpul sintezei. Dacă este necesar un substituent meta, substituentul este introdus la sau înainte de stadiul nitro; pentru substituenții Orto/para, acest lucru se poate face în stadiul NH2. Gruparea amino dintr – o arilamină (anilină) este un activator foarte puternic, astfel încât multe reacții EAS ale arilaminelor introduc rapid 2 sau 3 substituenți, cu excepția cazului în care reactivitatea grupării NH2 este moderată prin formarea unei amide-reamintim această metodă de protecție a aminelor prin acetilare, din capitolul 16. În unele cazuri, noul substituent poate fi, de asemenea, redus în timpul reducerii grupării nitro, ca în această sinteză a clorurii de meta-propilbenzendiazoniu din benzen:
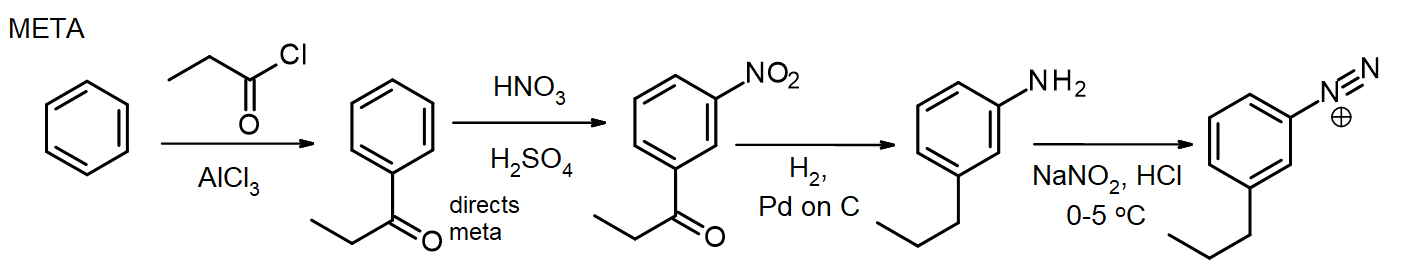
pentru sinteza izomerului para, arilamina este acetilată înainte de reacția Friedel-Crafts, apoi deacetilată prin încălzire cu exces de aq. HCl chiar înainte de diazotizare.

această sinteză a izomerilor para arată utilizarea grupării acetil pentru a controla reactivitatea grupării amino. (O sinteză alternativă ar putea evita acest lucru prin introducerea grupării propil mai întâi, înainte de nitrare.) Deși aceste sinteze par a fi lungi, ele implică pași sintetici care sunt fiabili și reproductibili și urmează un model standard. De asemenea, faptul că diferiți substituenți pot fi introduși în poziții selectate de-a lungul drumului face ca această abordare să fie o secvență sintetică foarte valoroasă.