- Hypofosforsyra kemiska egenskaper,användningsområden,produktion
- kontur
- kemiska egenskaper
- använder
- toxicitet
- riskidentifiering
- beredningsmetod
- produktionsmetod
- beskrivning
- beskrivning
- kemiska egenskaper
- fysikaliska egenskaper
- använder
- Definition
- beredning
- produktionsmetoder
- Definition
- reaktioner
- allmän beskrivning
- Luft & Vattenreaktioner
- Reaktivitetsprofil
- fara
- hälsofara
- brandrisk
- reningsmetoder
Hypofosforsyra kemiska egenskaper,användningsområden,produktion
kontur
Hypofosforsyra är också känd som ”hypofosfit” det är färglös olja eller deliquescenskristall , det är en viktig fin kemisk produkt. Den huvudsakliga användningen är som reduktionsmedel för elektrofri plätering, fosfor förhindra missfärgning av hartser, det kan också användas i förestring reaktionskatalysator, köldmedium, i synnerhet för produktion av hög renhet produkt natriumhypofosfit. Det finns flera metoder för beredning, den gemensamma industriella metoden för framställning är jonbytarhartsmetod och elektrodialysmetod.
de kemiska egenskaperna hos hypofosforsyra, användningar, toxicitet och produktionsmetoder redigeras av andy of Chemicalbook. (2016-12-04)
kemiska egenskaper
det är deliquescent kristaller eller färglös olja. Smältpunkt: 26,5 msk. Den relativa densiteten (specifik gravitation): 1.439 (fast, 19 kcal). Det är lösligt i vatten, etanol och eter, och det kan blandas i vilken proportion som helst med vatten, etanol, aceton. I luften är det lätt deliquesce till sirapig vätska, och den vattenhaltiga lösningen är sur.
Hypofosforsyra är monobasisk syra, i vattenhaltig lösning, Hypofosforsyra är stark syra, Ka = 10-2 (25 kg); det är relativt stabilt vid rumstemperatur; disproportioneringsreaktionen kan fortsätta vid 130 kg, sönderdelas i fosfin och fosforsyra:
2h3po2=H3PO4 + PH3
den har stark reduktion, tungmetallsaltlösning kan återställas till metaller som Cu2+, Hg2+, Ag+, såsom som:
4Ag + H3PO2 + 2h2)=4AG+H3PO4+4h+
det är svagt oxidationsmedel, det kan reduceras till fosfin, fosfin när man stöter på starkt reduktionsmedel.
använder
1. Hypofosforsyra används som reduktionsmedel för elektrofri plätering;
2. Det kan användas för att förhindra missfärgning av fosforsyraharts;
3. Det används som förestringskatalysator, köldmediet;
4. Det används för att producera hypofosfit, natriumsalter, mangansalter, järnsalter används vanligtvis som närande ämnen;
5. Hypofosforsyra används i medicin och som reduktionsmedel, bestämning av arsenik, tellur och separation av tantal, niob och andra reagens.
6. Det är starkt reduktionsmedel, det kan användas för framställning av natriumhypofosfit, kalciumfosfat och annan hypofosfit.
7. Den kan användas för pläteringsbadet. Läkemedel. reduktionsmedel. allmänna reagenser.
8. Det är starkt reduktionsmedel, det kan användas för att göra natriumhypofosfit, kalciumfosfat och annan hypofosfit.
9. Denna produkt används ofta som reduktionsmedel, Ag, Cu, Ni, Hg och andra metaller reduceras till motsvarande metall, för verifiering av As, Nb, Ta och andra reagens, den kan användas för framställning av Na, K, Ca, Mn, Fe och andra typer av hypofosfit.
toxicitet
det är icke brännbart. Men när kontakter med hålet h agent, kommer det att orsaka brand. När möter oxidationsmedel kan våldsam reaktion och förbränning fortsätta. När den värms upp till hög kan den sönderdelas i mycket giftig fosfingas eller till och med explodera. Det är frätande. Hypofosforsyra tillsätts ofta i läskedrycker och eftersom den inte absorberas. Så risken är liten, men särskilt stark hypofosfit skada gastrointestinal. Oavsiktligt stänker det i ögonen eller kontaktar huden, mycket vatten används för att tvättas. Produktionsoperatörer bör bära skyddskläder och andra skyddskläder. Produktionsutrustning ska förseglas, verkstaden ska ventileras väl.
riskidentifiering
faroangivelse:
orsakar allvarliga brännskador på huden och ögonskador.
orsakar allvarliga ögonskador
Skyddsangivelser:
andas inte in damm/rök/gas/dimma/ångor/spray.
tvätta noggrant efter hantering.
Använd skyddshandskar och ögon – /ansiktsskydd.
vid förtäring: Skölj munnen. Framkalla inte kräkningar.
vid hud (eller hår): ta omedelbart bort / Ta av alla förorenade kläder. Skölj huden med vatten / dusch.
vid kontakt med ögonen: skölj försiktigt med vatten i flera minuter. Ta bort kontaktlinser, om
är närvarande och lätt att göra. Fortsätt skölja.
vid inandning: ta bort offret i frisk luft och håll dig i vila i ett läge som är bekvämt för andning.
kontakta omedelbart en giftcentral eller läkare/läkare.
lagra inlåst.
kassera detta material och dess behållare till insamlingsplatsen för farligt avfall eller specialavfall.
beredningsmetod
1. Fosfor och bariumhydroxidlösning upphettas, bariumsalt Ba(H2PO2)2 * 2H2O kan generera, svavelsyra tillsätts i hypofosforsyrabariumlösning, Ba2+ kan fälla ut:
Ba(H2PO2) 2+H2SO4=BaSO4+2h3po2
Hypofosforsyra kan erhållas genom indunstning under reducerat tryck och kristallisering vid låg temperatur. På grund av i denna process är lösligheten av bariumsaltet liten, så koncentrationen av erhållen Hypofosforsyra är inte hög, industriprodukten bör renas genom omkristallisation.
2. den bariumoxid (eller kalk) och lösning av vit fosfor upphettas tillsammans för att bilda sekundär bariumfosfat (eller kalcium), och sedan reagerar med svavelsyra, det filtreras, koncentreras för att erhålla produkt, eller natriumhypofosfitlösning fortskrider h-typ jonbytarharts kan härleda produkt. Denna metod kräver en stor mängd harts, och hartsregenerering och tvättsteg är besvärligt, det kostar i allmänhet mer än $ 7 per pund, det är endast lämpligt för liten satsproduktion och inte lämplig för storskaliga industriella applikationer.
3. Hypofosforsyra framställs genom elektrodialysmetod, varvid elektrodialyscellen delar sig i tre delar, de är anodkammare, råmaterialkammare och katodkammare, mellanprodukten separeras med anjoniskt membran och katjoniskt membran, mellan två membran placeras natriumhypofosfitlösning (koncentration av 100 g/L~500 g/L), anodkammaren är utspädd lösning av Hypofosforsyra 5 g/L, anodkammaren är utspädd natriumhydroxidlösning ( 5 g /L), mellan polerna DC (3V~36V) placeras (koncentration av 100 g / l ~ godkänd, anod frigör syre och genererar sekundär produkt av hypofosforsyra; katod avger väte och genererar sekundär produkt av natriumhydroxid, reaktionstiden är 3~21h. reaktionerna av anodkammare och katodkammare är följande:
anodkammare:
H2O==h++OH-
2OH-==O2+2H2O+4e
H++H2PO2-==H3PO2
katodkammare:
H2O==h++OH-
2H++2e==H2
na++Oh-==NaOH
elektrodialysmetod för beredning hypofosforsyra är enkel och utrustningsinvesteringar är små, den är lämplig för massproduktion.
4. Med utgångspunkt från natriumhypofosfit av industriell kvalitet, CL -, SO42-anjoner som påverkar kvalitetsindikatorerna för Hypofosforsyra avlägsnas genom utfällning, tungmetalljoner avlägsnas från lösningen genom att bilda sulfid och sedan använda starkt syrakatjonbytarharts för att erhålla natrium sekundärt fosfat, produkt med hög renhet kan erhålla. Processen kan producera högkvalitativt sekundärt fosfat, tekniskt är möjligt, processen är enkel, enkel drift, bra produktkvalitet, den kan tillgodose behoven hos elektronikindustrin, försvarsindustrin och andra högteknologiska områden.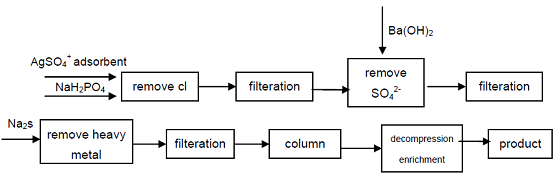
figur 1 produktionsprocess av Hypofosforsyra från industriell Natriumhypofosfit.
5. Jonbytarhartsmetod: cirka 70 g katjonbytarharts fuktat med vatten packas i ett glasrör med 5 mol/L saltsyra som cirkulerar cirka 15 min, efter noggrant tvättad med vatten, vattenhaltig natriumhypofosfitvattenlösning med hög renhet (15 g/60 ml H2O) strömmar genom den, hartskolonnen tvättas först med 50 ml, sedan med 25 RNL destillerat vatten. Avloppssyran och tvätt kombineras, den koncentreras genom avdunstning i vattenbad. Den koncentrerade syran placeras i högt vakuum med P205-torktumlare för uttorkning, kylning och kristallisering, filtrering, omkristallisering för att erhålla hypofosforsyraprodukt.
produktionsmetod
Jonbytarhartsmetod: sätt ca 70 g vattenlösliga katjonbytarhartser för att fylla i ett glasrör. Cirkulera med 5 mol/L saltsyra i ca 15 min och tvätta tillräckligt med vatten. Ha en hög vattenhaltig natriumhypofosfitlösning (15 g/60 ml H2O) för att strömma genom hartskolonnen, följt av att tvättas först med 50 ml vatten och sköljs sedan med 25 RNL destillerat vatten. Avloppssyran och tvättningarna kombinerades och koncentrerades genom avdunstning på ett vattenbad. Den koncentrerade syran skickas till högvakuumet, P205-torken för uttorkning, följt av kylkristallisering, filtrering och omkristallisering för att erhålla den färdiga produkten av hypofosforsyra.
beskrivning
Hypofosforsyra är ett kraftfullt reduktionsmedel med en molekylformel av H3PO2. Oorganiska kemisterhänvisa till den fria syran med detta namn även om dess IUPACname är dihydridohydroxidooxidofosfor, eller det godtagbara namnet på fosfinsyra. Det är en färglösslågsmältande förening, som är löslig i vatten,dioxan och alkoholer. Formeln för hypofosforsyra är i allmänhet skriven H3PO2, men en mer beskrivande presentation är HOP(O)H2 som framhäverdess monoprotiska karaktär. Salter härledda från denna syrakallas fosfinater (hypofosfiter).
beskrivning
denna syra har den allmänna formeln h4p2o6 och skiljer sig åtfrån de andra oxifosforsyrorna. Det har många peculiarities.It bildas tillsammans med fosfor och fosforsyror, när fosfor oxideras av fuktig luft.Om vit fosfor utsätts för luft och natriumacetattillsättstill vätskansom bildas, är det något olösligtnatriumhypofosfat, Na2H2P2O6·6h2oseparerar. Dennatriumhypofosfatmonohydrat är emellertid mycketlösligt och deliquescent vid 98,7 g/100 ml.
kemiska egenskaper
färglös vätska
fysikaliska egenskaper
färglösa deliquescent kristaller eller oljig vätska; sur lukt; densitet 1,493 g/cm3;smälter vid 26,5 CB C; kokar vid 130 CB c; mycket löslig i vatten, alkohol och eter; tätheten av en 50% vattenlösning är 1,13 g/mL.
använder
beredning av hypofosfiter, elektroplatingbad.
Definition
ChEBI: en fosforoxosyra som består av en enda pentavalent fosfor kovalent bunden via enkelbindningar till två väten och en hydroxigrupp och via en dubbelbindning till ett syre. Föräldern i klassen fosfinsyror.
beredning
Hypofosforsyra kan framställas med olika metoder:
1. Kokande vit fosfor med kalciumhydroxid:
P4 + 4CA(OH)2 + 8H2O msk 4CA (H2PO2)2 + 4H2
kalciumsaltet är lösligt i vatten. Behandling med svavelsyra gerhypofosforsyra:
(H2PO2)2CA + H2SO4 2H3PO2 + CaSO4
produktblandningen filtreras för att avlägsna olöslig CaSO4. Den vattenhaltiga lösningen av hypofosforsyra koncentreras under reducerat tryck.Koncentrerat baryta-vatten kan användas istället för kalciumhydroxid.2. Genom att behandla natriumhypofosfit, Nah2po2med ett jonbytarharts.Natriumsaltet kan framställas genom kokning av vit fosfor med en lösning av natriumhydroxid, en reaktion som liknar (1) ovan.
PH3 + 2i2 + 2H2O Bisexuell H3PO2 + 4HI
ovanstående metod kan anses vara säkrare än den som involverar uppvärmning av vitfosfor med en alkali.
Hypofosforsyra måste lagras under 50 kcal C. Det säljs kommersielltsom en vattenlösning i olika koncentrationer.
produktionsmetoder
Hypofosforsyra bildas genom reaktion av bariumhypofosfit och svavelsyra och filtrering av bariumsulfat. Genom indunstning av lösningen i vakuum vid 80 CCG, och därefter kylning till 0 CCG, kristalliserar hypofosforsyra.
Definition
ett vitt kristallint fast ämne. Det är en monobasisk syra som bildar anjonen H2PO2-i vatten. Natriumsaltet, och därmed syran, kan framställas genom upphettning av gul fosfor med natriumhydroxidlösning. Den fria syran och dess salter är kraftfulla reduktionsmedel.
reaktioner
Hypofosforsyra är blandbar med vatten i alla proportioner och en kommersiell styrka är 30% H3PO2. Hypofosfiter används i medicin. Hypofosforsyra är ett kraftfullt reduktionsmedel, t. ex.med kopparsulfat bildar kopparhydrid Cu2H2, brun fällning, som utvecklar vätgas och lämnar koppar vid uppvärmning; med silvernitrat ger finfördelat silver; med svavelsyra ger svavel och lite vätesulfid; med svavelsyra ger svavelsyra, som reagerar som ovan; bildar manganös omedelbart med permanganat.
allmän beskrivning
färglös oljig vätska eller deliquescent kristaller med en sur lukt. Densitet 1.439 g / cm3. Smältpunkt 26,5 msk C. inandning av ångor irriterar eller bränner luftvägarna. Vätska och ångor kan irritera eller bränna ögon och hud.
Luft & Vattenreaktioner
Deliquescent. Vattenlöslig.
Reaktivitetsprofil
HYPOFOSFORSYRA sönderdelas vid upphettning till fosforsyra och spontant brandfarligt fosfin. Oxideras av svavelsyra med frisättning av svaveldioxid och svavel. Reagerar explosivt med kvicksilver (II) oxid . Reagerar våldsamt med kvicksilver (II) nitrat . Neutraliserar baser i exoterma reaktioner.
fara
Brand-och explosionsrisk vid kontakt med oxidationsmedel.
hälsofara
giftigt; inandning, förtäring eller hudkontakt med material kan orsaka allvarlig skada eller dödsfall. Kontakt med smält ämne kan orsaka allvarliga brännskador på hud och ögon. Undvik hudkontakt. Effekterna av kontakt eller inandning kan fördröjas. Brand kan orsaka irriterande, frätande och/eller giftiga gaser. Avrinning från brandkontroll eller utspädningsvatten kan vara frätande och / eller giftigt och orsaka förorening.
brandrisk
icke brännbart, ämnet i sig brinner inte men kan sönderdelas vid uppvärmning för att producera frätande och/eller giftiga ångor. Vissa är oxidationsmedel och kan antända brännbara ämnen (trä, papper, olja, kläder etc.). Kontakt med metaller kan utveckla brandfarlig vätgas. Behållare kan explodera vid uppvärmning.
reningsmetoder
fosforsyra är en vanlig förorening av kommersiell 50% hypofosforsyra. Jenkins och Jones renade detta material genom att indunsta cirka 600 ml i en 1L-kolv vid 40o, under reducerat tryck (i N2), till en volym av cirka 300 ml. Efter att lösningen kyldes överfördes den till en bred mun Erlenmeyer-kolv som stoppades och lämnades i ett torris/acetonbad i flera timmar för att frysa (om nödvändigt med repor på väggen). När kolven sedan lämnades vid ca 5o i 12timmar, ca 30-40% av den flytande och filtrerades igen. Denna process upprepades, sedan lagrades det fasta ämnet över Mg (ClO4)2 i en vakuumtorkare i kylan. Efterföljande kristalliseringar från n-butanol genom att lösa upp den vid rumstemperatur och sedan kyla i ett issaltbad vid-20o verkade inte rena det ytterligare. Den fria syran bildar deliquescent kristaller m 26.5 O och är löslig i H2O och EtOH. Nah2po2-saltet kan renas genom ett anjonbytarharts