- Propiedades químicas del ácido hipofosforoso, Usos, Producción
- Contorno
- Propiedades químicas
- Usos
- Toxicidad
- IDENTIFICACIÓN DE PELIGROS
- Método de preparación
- Método de producción
- Descripción
- Descripción
- Propiedades químicas
- Propiedades físicas
- Usos
- Definición
- Preparado
- Métodos de producción
- Definición
- Reacciones
- Descripción general
- Reacciones al aire & Al agua
- Perfil de reactividad
- Peligro
- Peligro para la salud
- Peligro de incendio
- Métodos de purificación
Propiedades químicas del ácido hipofosforoso, Usos, Producción
Contorno
El ácido hipofosforoso también se conoce como «hipofosfito», es aceite incoloro o cristal de delicuescencia, es un producto químico fino importante. El uso principal es como agente reductor para el chapado electrolítico, el fosfórico evita la decoloración de las resinas, también se puede usar en el catalizador de reacción de esterificación, el refrigerante, en particular para la producción de hipofosfito de sodio de producto de alta pureza. Hay varios métodos para la preparación, el método industrial común para producir es el método de resina de intercambio iónico y el método de electrodiálisis.
Las propiedades químicas del ácido hipofosforoso, los usos, la toxicidad y los métodos de producción son editados por andy of Chemicalbook. (2016-12-04)
Propiedades químicas
Es cristales delicuescentes o aceite incoloro. Punto de fusión: 26.5℃. La densidad relativa (gravedad específica): 1.439 (sólido, 19℃). Es soluble en agua, etanol y éter, y puede ser mezclado en cualquier proporción con agua, etanol, acetona. En el aire, se convierte fácilmente en líquido almibarado, y la solución acuosa es ácida.
El ácido hipofosfórico es ácido monobásico, en solución acuosa, el ácido hipofosfórico es ácido fuerte, Ka = 10-2 (25℃); es relativamente estable a temperatura ambiente; la reacción de desproporción puede proceder a 130℃, descomponerse en fosfina y ácido fosforado:
2H3PO2=H3PO4+PH3
Tiene una fuerte reducción, la solución de sal de metales pesados se puede restaurar a metales como Cu2 +, Hg2 +, Ag +, tales como:
4Ag + H3PO2 + 2H2) = 4Ag + H3PO4 + 4H +
Es un oxidante débil, se puede reducir a fosfina, fosfina cuando se encuentra con un agente reductor fuerte.
Usos
1. El ácido hipofosforoso se utiliza como agente reductor para el chapado electrolítico;
2. Se puede usar para evitar la decoloración de la resina de ácido fosfórico;
3. Se utiliza como catalizador de esterificación, el refrigerante;
4. Se utiliza para producir hipofosfito, sales de sodio, sales de manganeso, sales de hierro generalmente se usan como sustancias nutritivas;
5. El ácido hipofosforoso se utiliza en medicina y como agente reductor, la determinación de arsénico, telurio y separación de tantalio, niobio y otros reactivos.
6. Es un agente reductor fuerte, se puede usar para la preparación de hipofosfito de sodio, fosfato de calcio y otros hipofosfitos.
7. Se puede utilizar para el baño de chapado. Productos farmacéuticos. agente reductor. reactivos generales.
8. Es un agente reductor fuerte, se puede usar en la fabricación de hipofosfito de sodio, fosfato de calcio y otros hipofosfitos.
9. Este producto es ampliamente utilizado como agente reductor, Ag, Cu, Ni, Hg y otros metales se reducen al metal correspondiente, para la verificación de As, Nb, Ta y otros reactivos, se puede usar para la preparación de Na, K, Ca, Mn, Fe y otros tipos de hipofosfito.
Toxicidad
Es incombustible. Pero cuando entra en contacto con el agente de agujero H, causará fuego. Cuando se encuentra con el agente oxidante, la reacción violenta y la combustión pueden proceder. Cuando se calienta a alta temperatura, puede descomponerse en gas fosfina altamente tóxico, o incluso explotar. Es corrosivo. El ácido hipofosforoso a menudo se agrega a los refrescos, y porque no se absorbe. Por lo tanto, el riesgo es pequeño, pero el hipofosfito particularmente fuerte duele gastrointestinal. Accidentalmente salpica en los ojos o entra en contacto con la piel, se usa mucha agua para lavarse. Los operadores de producción deben usar ropa protectora y otra ropa protectora. El equipo de producción debe estar sellado, el taller debe ventilarse bien.
IDENTIFICACIÓN DE PELIGROS
Indicación de peligro:
Provoca quemaduras graves en la piel y daños oculares.
Causa daños oculares graves
Consejos de prudencia:
No respire polvo / humo/gas/niebla/vapores / aerosol.
Lavar bien después de manipular.
Use guantes protectores y protección para los ojos y la cara.
EN CASO DE INGESTIÓN: Enjuáguese la boca. NO induzca el vómito.
EN CASO DE CONTACTO CON LA PIEL( o el cabello): Quítese/quítese inmediatamente toda la ropa contaminada. Enjuague la piel con agua / ducha.
EN CASO DE CONTACTO CON LOS OJOS: Enjuague cuidadosamente con agua durante varios minutos. Retire las lentes de contacto, si
están presentes y son fáciles de hacer. Continúe enjuagando.
EN CASO DE INHALACIÓN: Retire a la víctima al aire fresco y manténgala en reposo en una posición cómoda para respirar.
Llame inmediatamente a un CENTRO DE TOXICOLOGÍA o a un médico.
Tienda cerrada.
Deseche este material y su contenedor en un punto de recogida de residuos peligrosos o especiales.
Método de preparación
1. La solución de hidróxido de fósforo y bario se calienta, la sal de bario Ba (H2PO2) 2 • 2H2O puede generar, el ácido sulfúrico se agrega a la solución de bario de ácido hipofosfórico, Ba2+ puede precipitar:
Ba(H2PO2)2+H2SO4=BaSO4+2H3PO2
El ácido hipofosfórico se puede obtener evaporándose a presión reducida y cristalización a baja temperatura. Debido a este proceso, la solubilidad de la sal de bario es pequeña, por lo que la concentración de ácido hipofosforoso obtenido no es alta, el producto industrial debe purificarse mediante recristalización.
2. el óxido de bario (o cal) y la solución de fósforo blanco se calientan juntos para formar fosfato de bario secundario (o calcio), y luego reacciona con ácido sulfúrico, se filtra, se concentra para obtener el producto, o la solución de hipofosfito de sodio procede, la resina de intercambio iónico de tipo H puede derivar el producto. Este método requiere una gran cantidad de resina, y el paso de regeneración y lavado de la resina es engorroso, generalmente cuesta más de 7 7 por libra, solo es adecuado para la producción de lotes pequeños y no es adecuado para aplicaciones industriales a gran escala.
3. El ácido hipofosforoso se prepara mediante el método de electrodiálisis, en el que la celda de electrodiálisis se divide en tres partes, son cámara de ánodo, cámara de materia prima y cámara de cátodo, el intermedio está separado por membrana aniónica y membrana catiónica, entre dos membranas se coloca una solución de hipofosfito de sodio (concentración de 100 g/L~500 g/L), la cámara de ánodo es una solución diluida de ácido hipofosforoso 5g/L, la cámara de ánodo es una solución diluida de hidróxido de sodio ( 5 g /L), entre los polos DC (3 V~36V), el ánodo libera oxígeno y genera un producto secundario de ácido hipofosforoso; El cátodo emite hidrógeno y genera un producto secundario de hidróxido de sodio, el tiempo de reacción es de 3~21h. Las reacciones de la cámara de ánodo y la cámara de cátodo son las siguientes:
cámara de ánodo:
H2O==H++OH-
2OH-==O2+2H2O+4e
H++H2PO2-==H3PO2
cámara de cátodo:
H2O==H++OH-
2H++2e==H2
Na++OH-==NaOH
Método de electrodiálisis de preparación El ácido hipofosforoso es simple y la inversión en equipos es pequeña, es adecuada para la producción en masa.
4. A partir del hipofosfito de sodio de grado industrial, los aniones Cl, SO42 que afectan los indicadores de calidad del ácido hipofosforoso se eliminan por precipitación, los iones de metales pesados se eliminan de la solución formando sulfuro y luego utilizando resina de intercambio de cationes ácidos fuertes para obtener fosfato secundario de sodio, se puede obtener un producto de grado de alta pureza. El proceso puede producir fosfato secundario de alta calidad, técnicamente es factible, el proceso es simple, fácil operación, buena calidad del producto, puede satisfacer las necesidades de la industria electrónica, la industria de defensa y otros campos de alta tecnología.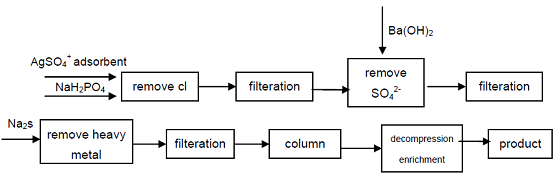
figura 1 Proceso de Producción de Ácido Hipofosforoso a partir de Hipofosfito de Sodio Industrial.
5. Método de resina de intercambio iónico: aproximadamente 70 g de resina de intercambio catiónico humedecida con agua se envasa en un tubo de vidrio con ácido clorhídrico de 5 mol/L que circula aproximadamente 15 minutos, después de lavarse a fondo con agua, la solución acuosa de hipofosfito de sodio acuoso de alta pureza (15 g/60 ml H2O) fluye a través de ella, la columna de resina se lava primero con 50 ml, luego con 25 rnl de agua destilada. El ácido efluente y el lavado se combinan, se concentra por evaporación en baño de agua. El ácido concentrado se coloca en alto vacío con P205 secador de deshidratación, enfriamiento y cristalización, filtración, recristalización, para obtener ácido hipofosforoso producto.
Método de producción
Método de resina de intercambio iónico: coloque aproximadamente 70 g de resinas de intercambio catiónico solubles en agua para rellenarlas en un tubo de vidrio. Circule con 5 mol/L de ácido clorhídrico durante unos 15 minutos y lave lo suficiente con agua. Disponer de una solución de hipofosfito sódico con alto contenido de agua (15 g / 60 ml de H2O) para que fluya a través de la columna de resina, después lavarse primero con 50 ml de agua y, a continuación, enjuagarse con 25 litros de agua destilada. El ácido efluente y los lavados se combinaron y concentraron por evaporación en un baño de agua. El ácido concentrado se envía al secador P205 de alto vacío para la deshidratación, seguido de cristalización por enfriamiento, filtración y recristalización para obtener el producto terminado de ácido hipofosforoso.
Descripción
El ácido hipofosforoso es un poderoso agente reductor con una fórmula molecular de H3PO2. Los químicos inorgánicos se refieren al ácido libre con este nombre, aunque su nombre IUPAC es dihidridohidroxidooxidofosforo, o el nombre aceptable de ácido fosfínico. Es un compuesto de fusión lenta sin color, soluble en agua,dioxano y alcoholes. La fórmula para el ácido hipofosforoso generalmente se escribe H3PO2, pero una presentación más descriptiva es HOP(O)H2 que resalta su carácter monoproteico. Las sales derivadas de este ácido se denominan fosfinatos (hipofosfitos).
Descripción
Este ácido tiene la fórmula general de H4p2o6 y se diferencia de los otros ácidos oxi-fosforosos. Tiene muchos peculiarities.It se forma junto con el fósforo y los fosforicácidos, cuando el fósforo es oxidado por el aire húmedo.Si el fósforo blanco se expone al aire, y el acetato de sodio se agrega al líquido que se forma, el hipofosfato de sodio algo insoluble,Na2H2P2O6·6H2 se separa. El monohidrato de hipofosfato de sodio, sin embargo, es muy soluble y delicuescente a ~ 98,7 g/100 ml.
Propiedades químicas
líquido incoloro
Propiedades físicas
Cristales delicuescentes incoloros o líquido aceitoso; olor agrio; densidad 1,493 g/cm3;se derrite a 26,5°C; hierve a 130°C; muy soluble en agua, alcohol y éter; densidad de una solución acuosa al 50% es 1,13 g/ml.
Usos
Preparación de hipofosfitos, baños de galvanoplastia.
Definición
ChEBI: oxoácido de fósforo que consiste en un fósforo pentavalente único unido covalentemente a través de enlaces simples a dos hidrógenos y un grupo hidroxilo y a través de un enlace doble a un oxígeno. El padre de la clase de ácidos fosfínicos.
Preparado
El ácido hipofosforoso puede prepararse por diversos métodos:
1. Fósforo blanco hirviendo con hidróxido de calcio:
P4 + 4Ca(OH)2 + 8H2O → 4Ca (H2PO2)2 + 4H2
La sal de calcio es soluble en agua. El tratamiento con ácido sulfúrico produce ácido hipofosforoso:
(H2PO2) 2Ca + H2SO4 → 2H3PO2 + CaSO4
La mezcla del producto se filtra para eliminar CaSO4 insoluble. La solu-ción acuosa del ácido hipofosforoso se concentra a presión reducida.Se puede utilizar agua de barita concentrada en lugar de hidróxido de calcio.2. Tratando hipofosfito de sodio, nah2po2con una resina de intercambio iónico.La sal sódica puede producirse hirviendo fósforo blanco con una solución de hidróxido de sodio, una reacción similar a (1) anterior.
PH3 + 2I2 + 2H2O → H3PO2 + 4HI
El método anterior puede considerarse más seguro que el que consiste en calentar el fósforo blanco con un álcali.
El ácido hipofosforoso debe almacenarse a menos de 50°C. Se vende comercialmentecomo solución acuosa a diversas concentraciones.
Métodos de producción
El ácido hipofosforoso se forma por reacción de hipofosfito de bario y ácido sulfúrico, y filtrado de sulfato de bario. Por evaporación de la solución en vacío a 80 ° C, y luego enfriamiento a 0°C, el ácido hipofosforado se cristaliza.
Definición
Sólido cristalino blanco. Es un ácido monobásico que forma el anión H2PO2 en el agua. La sal de sodio, y por lo tanto el ácido, se puede preparar calentando fósforo amarillo con solución de hidróxido de sodio. El ácido libre y sus sales son potentes agentes reductores.
Reacciones
El ácido hipofosforoso es miscible con agua en todas las proporciones y una fuerza comercial es 30% H3PO2. Los hipofosfitos se usan en medicina. El ácido hipofosforoso es un poderoso agente reductor, por ejemplo, con sulfato de cobre forma hidruro cuproso Cu2H2, precipitado marrón, que desarrolla gas hidrógeno y deja cobre al calentarse; con nitrato de plata produce plata finamente dividida; con ácido sulfuroso produce azufre y algo de sulfuro de hidrógeno; con ácido sulfúrico produce ácido sulfuroso, que reacciona como se indica arriba; forma manganoso inmediatamente con permanganato.
Descripción general
Líquido aceitoso incoloro o cristales delicuescentes con olor agrio. Densidad 1,439 g / cm3. Punto de fusión 26,5 ° C. La inhalación de vapores irrita o quema el tracto respiratorio. Los líquidos y vapores pueden irritar o quemar los ojos y la piel.
Reacciones al aire & Al agua
Delicuescentes. Soluble en agua.
Perfil de reactividad
El ÁCIDO HIPOFOSFOROSO se descompone al calentarse en ácido fosfórico y fosfina inflamable espontáneamente. Es oxidado por ácido sulfúrico con liberación de dióxido de azufre y azufre. Reacciona explosivamente con óxido de mercurio (II). Reacciona violentamente con nitrato de mercurio (II). Neutraliza bases en reacciones exotérmicas.
Peligro
Riesgo de incendio y explosión en contacto con agentes oxidantes.
Peligro para la salud
TÓXICO; la inhalación, la ingestión o el contacto de la piel con el material puede causar lesiones graves o la muerte. El contacto con sustancias fundidas puede causar quemaduras graves en la piel y los ojos. Evite cualquier contacto con la piel. Los efectos del contacto o la inhalación pueden retrasarse. El fuego puede producir gases irritantes, corrosivos y/o tóxicos. La escorrentía del agua de control de incendios o de dilución puede ser corrosiva y / o tóxica y causar contaminación.
Peligro de incendio
No combustible, la sustancia en sí no se quema, pero puede descomponerse al calentarse para producir humos corrosivos y / o tóxicos. Algunos son oxidantes y pueden encender combustibles (madera, papel, aceite, ropa, etc.).). El contacto con metales puede producir gas hidrógeno inflamable. Los contenedores pueden explotar cuando se calientan.
Métodos de purificación
El ácido fosforoso es un contaminante común del ácido hipofosforoso comercial al 50%. Jenkins y Jones purificaron este material evaporando aproximadamente 600 ml en un matraz de 1 LITRO a 40o, a presión reducida (en N2), a un volumen de aproximadamente 300 ml. Después de enfriar la solución, se transfirió a un matraz Erlenmeyer de boca ancha que se tapó y se dejó en un baño de hielo seco/acetona durante varias horas para que se congelara (si fuera necesario, con arañazos en la pared). Cuando el matraz se dejó a aproximadamente 5o durante 12 horas, aproximadamente el 30-40% de él se licuó y se filtró de nuevo. Este proceso se repitió, luego el sólido se almacenó sobre Mg (ClO4) 2 en un desecador al vacío en frío. Las cristalizaciones posteriores a partir de n-butanol, disolviéndolo a temperatura ambiente y luego enfriándolo en un baño de sal helada a-20o, no parecían purificarlo más. El ácido libre forma cristales delicuescentes m 26,5 o y es soluble en H2O y EtOH. La sal NaH2PO2 se puede purificar a través de una resina de intercambio de aniones