- fluorescens Digital Billedgalleri
- Madin-Darby Canine nyre epitelceller (Mdck linje)
- yderligere Fluorescensbilleder af Madin-Darby Canine nyre (Mdck) celler
- spørgsmål eller kommentarer? Send os en mail.
- 1998-2021 af Michael Davidson og Florida State University. Alle Rettigheder Forbeholdes. Ingen billeder, grafik, scripts eller applets må gengives eller bruges på nogen måde uden tilladelse fra indehaverne af ophavsretten. Brug af denne hjemmeside betyder, at du accepterer alle de juridiske vilkår og betingelser, der er angivet af ejerne.
- denne hjemmeside vedligeholdes af vores grafik&Internetprogrammeringsteami samarbejde med optisk mikroskopi på National High Magnetic Field Laboratory.
- sidste ændring: fredag, November 13, 2015 på 02: 19 PM
- adgang tæller siden juli 16, 2004: 79076
- mikroskoper, fluorescensfiltre og digitalt billedudstyr leveret af:
fluorescens Digital Billedgalleri
Madin-Darby Canine nyre epitelceller (Mdck linje)
afledt af S. H. Madin og N. B. Darby fra nyrevævet hos en voksen kvindelig cocker spaniel, stammer mdck-cellelinjen i September 1958. Siden da er cellerne blevet anvendt i vid udstrækning til at undersøge behandlingen af beta-amyloidprecursorprotein såvel som sorteringen af dets proteolytiske produkter.
en af de mest almindelige typer af keratinceller er keratinceller, der bruges til behandling af keratinceller. Vira, som mdck-celler er modtagelige for, omfatter vesikulær stomatitis (Indiana-stamme), vaccinia, coksackivirus B5, reovirus 2 og 3, adenovirus 4 og 5, vesikulært eksantem hos svin og infektiøs hepatitis hos hunde. Cellerne udviser resistens over for coksackivirus B3 og B4 såvel som poliovirus 2 og er negative for revers transkriptase.
mdck-linjen bruges almindeligvis som en generel model for epitelceller, der omfatter den type væv, der kaldes epitel. Hovedsageligt fundet dækker de indre organer og andre overflader af kroppen, epitel består af tætpakkede celler, der er organiseret i ark. Disse celler udskiller en ekstracellulær matrice kaldet basal lamina ved deres base, som hjælper med at forankre epitelvævet til tilstødende væv. Epitelceller mangler også direkte adgang til blodkar og skal derfor opnå ilt og næringsstoffer gennem diffusion, på samme måde som de er tvunget til at slippe af med metaboliske affaldsprodukter. Epithelia fungerer i en række mekanismer, herunder beskyttelse, absorption, sensorisk modtagelse og sekretion. Nyrernes epitelceller spiller en central rolle i den midlertidige opbevaring og efterfølgende udskillelse af udskillelsesmaterialer.
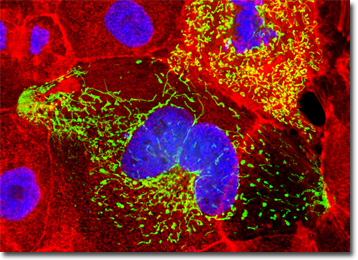
kulturen af Madin-Darby hundenyreceller præsenteret i det digitale billede ovenfor blev mærket med DAPI og Aleksa Fluor 568 konjugeret til phalloidin, som målretter DNA i cellekernen og f-actin cytoskeletale netværk, henholdsvis. Derudover blev cellerne transficeret med en pEYFP-mitokondrier (forbedret gult fluorescerende protein) kimærisk plasmid subcellulær lokaliseringsvektor. Billeder blev optaget i gråtoner med et kamera system koblet til et Olympus 51 mikroskop udstyret med båndpas emission fluorescens filter optiske blokke leveret af Omega Optical. Under behandlingsfasen blev individuelle billedkanaler pseudocolored med RGB-værdier svarende til hver af fluorophore emission spektrale profiler.
yderligere Fluorescensbilleder af Madin-Darby Canine nyre (Mdck) celler
Mdck-epitelceller med Mitotracker Red Cmksros, Aleksa Fluor 488 og DAPI – en vedhængende kultur af Madin-Darby hunde nyreceller blev mærket for det intracellulære mitokondrie netværk og for filamentøs actin med MitoTracker Red Cmksros og Aleksa Fluor 488 konjugeret til henholdsvis phalloidin. Den ultraviolet-absorberende probe DAPI blev anvendt til at modvirke DNA.
![]()
målretning af Peroksisomer og Clathrinproteiner i Madin-Darby nyreceller med immunofluorescens – i dette afsnit blev den fremhævede kultur af mdck-celler immunofluorescent mærket med primære monoklonale antistoffer mod clathrin (tung kæde) mus efterfulgt af gede anti-mus Fab-fragmenter konjugeret til cyaninfarvestoffet Cy3 for at målrette det cytoskeletale netværk. Derudover blev peroksisomer til stede i kulturen immunofluorescent mærket med Cy2 konjugeret til ged sekundære antistoffer rettet mod kanin anti-PMP 70 (peroksisomalt membranprotein 70) primære antistoffer. Kerner blev modfarvet med Hoechst 33342.
![]()
forbedret Gul Protein subcellulær lokalisering af mitokondrier i Mdck – cellekulturer-en kultur af Madin-Darby hundenyrepitelceller blev transficeret med en pEYFP-mitokondrier (forbedret gult fluorescerende protein) kimærisk plasmid subcellulær lokaliseringsvektor. Cellerne blev også farvet med orange og Aleksa Fluor 350 konjugeret til phalloidin, rettet mod DNA og det cytoskeletale filamentøse actinnetværk.
![]()
Immunofluorescensmålretning af histonerne og Golgi – komplekset i Nyrepitelcellekulturer hos hunde-Madin-Darby nyreceller hos hunde blev fikseret med paraformaldehyd, permeabiliseret og behandlet med en blanding af primære antistoffer fra kaniner (anti-giantin) og mus (anti-histoner; pan) efterfulgt af sekundære antistoffer konjugeret med hhv. Den sekundære antistofcocktail indeholdt også Aleksa Fluor 350 konjugeret til phalloidin, designet til samtidig at målrette mod det filamentøse actin-netværk.
![]()
Dobbelt immunofluorescens af nukleare Porekompleksproteiner og tætte forbindelser i Madin-Darby Canine nyreceller – Epitelcelletætte forbindelser og nukleare porekompleksproteiner blev samtidigt afbildet i mdck-celler med en cocktail af primære antistoffer mod NPCP og kanin-anti-O-3, efterfulgt af sekundære antistoffer mod mus og anti-kanin konjugeret med hhv.Aleksa Fluor 488 og Aleksa Fluor 568.
![]()
mitokondrie – netværket i Mdck-celler-en vedhæftende monolagskultur af Madin-Darby-hundenyreceller blev immunofluorescent mærket med primære museproteinantistoffer mod kompleks v-hæmmer, efterfulgt af gede anti-mus Fab-fragmenter konjugeret til fluorescein. Kulturen blev efterfølgende farvet med Aleksa Fluor 568 konjugeret til phalloidin for at afsløre detaljer om det filamentøse actinnetværk og DAPI for DNA i kernen.
![]()
Mdck – celler med Hvedekimagglutinin-lectiner er en specialiseret klasse af planteproteiner, der binder til specifikke kulhydratgrupper bundet til proteiner eller bosat i cellemembraner. Et fremtrædende medlem af denne gruppe, hvedekim agglutinin bruges ofte til at lokalisere Golgi-komplekset i fluorescensmærkningseksperimenter. Kulturen illustreret i dette afsnit blev mærket med hvedekim agglutinin konjugeret til rød, samt Aleksa Fluor 488 konjugeret til phalloidin og DAPI (målretning DNA i kernen).
![]()
målretning af mitokondrier med fluorescerende proteiner i hunde – Nyrecellekulturer-en semi-sammenflydende kultur af mdck-celler blev transient transfekteret med en plasmidkimera indeholdende den kodende sekvens for forbedret gult fluorescerende protein (EYFP) fusioneret til den mitokondrie målretningssekvens fra underenhed VIII af human cytokrom C-oksidase. Efter fiksering og permeabilisering blev cellerne modfarvet for filamentøst actin med Aleksa Fluor 546 konjugeret til phalloidin og for DNA med det nukleare specifikke farvestof, DAPI.
![]()
stramme kryds i Madin-Darby Canine Nyrecellekulturer – det stramme knudeprotein til-3 blev visualiseret ved immunofluorescens i en sammenflydende kultur af mdck-celler. Kanin-anti-to-3-antistoffer rettet mod proteinet blev mærket med sekundære fab-fragmenter fra ged-anti-kanin konjugeret til cyaninfarvestoffet, Cy3. Kernerne blev modfarvet med den DNA-specifikke fluorophore DAPI.
![]()
Mdck adhærente cellekulturer med rød, Aleksafluor 488 og Aleksafluor 350 – i et dobbelt immunofluorescensmærkningseksperiment blev en kultur af mdck-celler behandlet med en cocktail af musantihistoner (pan) og kanin-anti-PMP 70 (peroksisomalt membranprotein) primære antistoffer. Målproteinerne blev efterfølgende visualiseret med sekundære antistoffer mod gede-mus og anti-kanin konjugeret til hhv.rød og Aleksa Fluor 488. Det filamentøse actin-cytoskeletale netværk blev modfarvet med Aleksa Fluor 350 konjugeret til phalloidin.
![]()
klassiske farvemønstre i Nyrepitelceller – den nu traditionelle og populære kombination af Mitotracker Red Cmksros, Aleksa Fluor 488 konjugeret til phalloidin og Hoechst 33342 blev brugt til at tredoble en vedhæftende kultur af mdck-celler. Bemærk det usædvanlige filamentøse actin-netværk og det store antal mitokondrier, der omgiver kernerne i disse celler.
![]()
subcellulær lokalisering af mitokondrier med fluorescerende proteiner i Mdck – celler-efter fiksering og permeabilisering blev kulturen af mdck-celler præsenteret i dette afsnit mærket med propidiumiodid og Aleksa Fluor 350 konjugeret til phalloidin, som målretter henholdsvis DNA og filamentøs actin. Derudover blev cellerne først transficeret med en peyfp-mitokondrier plasmid subcellulær lokaliseringsvektor, hvorved der lokaliseres et gult fluorescerende proteinmærke til det intracellulære mitokondrielle netværk.
![]()
det omfattende Tubulinnetværk i Madin-Darby – Nyrepitelceller til hunde-mikrotubuli blev farvet ved anvendelse af immunofluorescens ved behandling af en fast og permeabiliseret kultur af mdck-celler med primære antistoffer mod mus-anti-alfa-tubulin efterfulgt af antistoffer mod mus, der er konjugeret med Aleksa Fluor 568. Kerner blev modfarvet med SYTOKSGRØN. Selvom det ikke er afbildet i dette afsnit, blev kulturen også mærket med Aleksa Fluor 350 konjugeret til phalloidin.
![]()
samtidig visualisering af Clathrin, Peroksisomer og kerner i Mdck – cellekulturer-kulturen af mdck-celler præsenteret i dette afsnit blev immunofluorescent mærket med primære monoklonale antistoffer mod clathrin (tung kæde) mus efterfulgt af gede anti-mus Fab-fragmenter konjugeret til cyaninfarvestoffet Cy3 for at målrette det cytoskeletale netværk. Derudover blev peroksisomer til stede i kulturen immunofluorescent mærket med Cy2 konjugeret til sekundære gedeantistoffer rettet mod kanin-anti-PMP 70 (peroksisomalt membranprotein 70) primære antistoffer. Kerner blev modfarvet med Hoechst 33342.
![]()
Cytokeratin – Mellemfilamentnetværket i hunde-Nyrepitelceller-Cytokeratin er en almindelig og rigelig komponent i det mellemliggende filamentnetværk i epitelceller. Den vedhængende kultur i dette afsnit blev immunofluorescent mærket med primære antistoffer mod mus-cytokeratin (pan) efterfulgt af sekundære antistoffer mod mus, der er konjugeret til Marina Blue. Mitokondrier blev visualiseret med Mitotracker røde Cmkser, og kernerne blev farvet med SYTOKSGRØN.
![]()
Madin-Darby Hundenyreceller med Aleksafluor 488, Aleksafluor 568 og Hoechst 33258 – samtidig lokalisering af stramme kryds og de nukleare porekompleksproteiner (NPCP) blev udført med et dobbelt immunofluorescenseksperiment med mdck-celler ved anvendelse af primære antistoffer mod mus-NPCP og kaninantiso-3. De subcellulære mål blev visualiseret ved hjælp af gede-anti-mus og anti-kanin sekundære antistoffer (IgG) konjugeret til henholdsvis Aleksa Fluor 488 og Aleksa Fluor 568. DNA i kernerne blev modfarvet under anvendelse af Hoechst 33258.
![]()
immunofluorescerende mærkning af Mitokondrienetværket i Mdck – cellekulturer-Madin-Darby hundenyreceller blev immunofluorescent mærket med primære Muse-antioksfos-kompleks v-hæmmerproteinantistoffer efterfulgt af gede-anti-mus Fab-fragmenter konjugeret til fluorescein. Kulturen blev efterfølgende farvet med Aleksa Fluor 568 konjugeret til phalloidin for at afsløre detaljer om det filamentøse actinnetværk og DAPI for DNA i kernen.
![]()
MitoTracker Red Cmksros, Cy2 og Hoechst 33258 i Madin-Darby Canine nyreceller – en fast og permeabiliseret vedhæftende kultur af Madin-Darby canine nyreceller blev immunofluorescent mærket med primære musanticytokeratinantistoffer efterfulgt af Fab-fragmenter fra Goat Anti-mouse konjugeret til cyaninfarvestoffet, Cy2. Før fiksering blev kulturen behandlet i en time med Mitotracker Red Cmksros, og efter antistofbehandlingerne blev kernerne modfarvet med Hoechst 33258.
![]()
Binding af lectiner til Golgi – komplekset i Mdck-Epitelcellekulturer-for at visualisere lectinbinding til Golgi-komplekset i mdck-celler blev en klæbende kultur behandlet med hvedekim agglutinin konjugeret til Oregon Green. Cellerne blev efterfølgende modfarvet med Aleksa Fluor 568 konjugeret til phalloidin for at lokalisere det filamentøse actinnetværk og nukleinsyrefarven DAPI for at mærke DNA i kernen.
![]()
adhærente Mdck – celler med aleksafluor 488, Aleksafluor 568 og Hoechst 33342-aleksafluorfarvestoffer blev anvendt til at visualisere fordelingen af clathrin og det peroksisomale membranprotein 70 (PMP 70) i en kultur af Madin-Darby-nyrepitelceller. Efter immunofluorescensreaktionerne blev cellerne modfarvet med Hoechst 33342 for at afsløre placeringen af kernerne.
![]()
Madin – Darby Hundenyreceller med Mitotracker Red Cmksros, Aleksa Fluor 488 og DAPI-en af de mest nyttige fluoroforkombinationer til visualisering af interne cellulære detaljer inkluderer Mitotracker Red Cmksros til at målrette mitokondrier, Aleksa Fluor 488 konjugeret til phalloidin til det filamentøse actin-netværk og DAPI til at lokalisere kernerne.
![]()
visualisering af mikrotubuli – og Actin-cytoskeletale netværk i Mdck-cellekulturer-for samtidig at visualisere både actin-og tubulin-netværk i mdck-celler blev en fast og permeabiliseret kultur behandlet med primære antistoffer mod alfa-tubulin fra mus, efterfulgt af en cocktail af sekundære antistoffer mod mus konjugeret til Aleksa Fluor 568 blandet sammen med Aleksa Fluor 350 konjugeret til phalloidin. Kerner blev modfarvet med SYTOKSGRØN.
![]()
Dobbelt immunofluorescens af nukleare Porekompleksproteiner og tætte forbindelser i Madin-Darby Canine nyreceller – Epitelcelletætte forbindelser og nukleare porekompleksproteiner blev samtidigt afbildet i mdck-celler med en cocktail af primære antistoffer mod mus og primære antistoffer mod kanin og sekundære antistoffer mod geder konjugeret med henholdsvis Aleksa Fluor 568 og Aleksa Fluor 488. Kerner blev modfarvet med Hoechst 33258.
![]()
nærhed af kernen og Golgi – komplekset i monolag Mdck-cellekulturer-den tætte nærhed mellem Golgi-komplekset og kernerne i Madin-Darby hunde-nyreceller blev undersøgt i et dobbelt immunofluorescenseksperiment med Muse-anti-NPCP (nukleart porekompleksprotein) og kanin-anti-giantin (Golgi-kompleks) primære antistoffer. Antistofmålene blev visualiseret med gede sekundære antistoffer konjugeret til henholdsvis Aleksa Fluor 568 og Aleksa Fluor 488, mens actins cytoskeletale ramme blev mærket med Aleksa Fluor 350 konjugeret til phalloidin.
tilbage til de dyrkede celler FLUORESCENSGALLERI
tilbage til FLUORESCENSGALLERIET
spørgsmål eller kommentarer? Send os en mail.
1998-2021 af Michael Davidson og Florida State University. Alle Rettigheder Forbeholdes. Ingen billeder, grafik, scripts eller applets må gengives eller bruges på nogen måde uden tilladelse fra indehaverne af ophavsretten. Brug af denne hjemmeside betyder, at du accepterer alle de juridiske vilkår og betingelser, der er angivet af ejerne.
denne hjemmeside vedligeholdes af vores
grafik&Internetprogrammeringsteam
i samarbejde med optisk mikroskopi på
National High Magnetic Field Laboratory.
sidste ændring: fredag, November 13, 2015 på 02: 19 PM
adgang tæller siden juli 16, 2004: 79076
mikroskoper, fluorescensfiltre og digitalt billedudstyr leveret af:
![]()
![]()
![]()