- Galerie d’images Numériques à Fluorescence
- Cellules Épithéliales Rénales Canines de Madin-Darby (Ligne MDCK)
- Images de fluorescence supplémentaires de Cellules Rénales Canines de Madin-Darby (MDCK)
- Questions ou commentaires? Envoyez-nous un email.
- © 1998-2021 par Michael W. Davidson et l’Université d’État de Floride. Tous Droits réservés. Aucune image, graphique, script ou applets ne peut être reproduit ou utilisé de quelque manière que ce soit sans l’autorisation des détenteurs des droits d’auteur. L’utilisation de ce site Web signifie que vous acceptez toutes les Conditions légales énoncées par les propriétaires.
- Ce site Web est maintenu par notre Équipe de Programmation Web Graphique &en collaboration avec la Microscopie Optique au Laboratoire National de Champ Magnétique Élevé .
- Dernière modification : Vendredi 13 Novembre 2015 à 14h19
- Nombre d’accès Depuis Juillet 16, 2004: 79076
- Microscopes, filtres à fluorescence et équipement d’imagerie numérique fournis par :
Galerie d’images Numériques à Fluorescence
Cellules Épithéliales Rénales Canines de Madin-Darby (Ligne MDCK)
Dérivée par S. H. Madin et N.b. Darby du tissu rénal d’un épagneul cocker femelle adulte, la lignée cellulaire MDCK est née en septembre 1958. Depuis lors, les cellules ont été largement utilisées pour étudier le traitement de la protéine précurseur de la bêta-amyloïde, ainsi que le tri de ses produits protéolytiques.
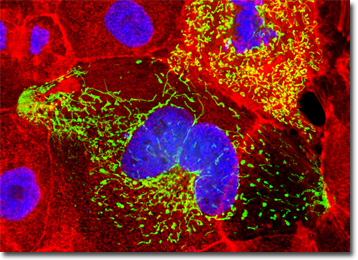
La morphologie de la lignée cellulaire MDCK est épithéliale et les cellules sont positives pour la kératine par coloration immunoperoxydase. Les virus auxquels les cellules MDCK sont sensibles comprennent la stomatite vésiculaire (souche Indiana), la vaccine, le coxsackievirus B5, les réovirus 2 et 3, les adénovirus 4 et 5, l’exanthème vésiculaire des porcs et l’hépatite canine infectieuse. Les cellules présentent une résistance aux coxsackievirus B3 et B4 ainsi qu’au poliovirus 2, et sont négatives pour la transcriptase inverse.
La lignée MDCK est couramment utilisée comme modèle général pour les cellules épithéliales, qui comprennent le type de tissu appelé épithélium. Principalement trouvé couvrant les organes internes et d’autres surfaces du corps, l’épithélium est composé de cellules serrées qui sont organisées en feuilles. Ces cellules sécrètent une matrice extracellulaire appelée lame basale à leur base, qui aide à ancrer le tissu épithélial aux tissus adjacents. Les cellules épithéliales manquent également d’accès direct aux vaisseaux sanguins et doivent donc obtenir de l’oxygène et des nutriments par diffusion, de la même manière qu’elles sont obligées de se débarrasser des déchets métaboliques. Les épithéliums fonctionnent dans une variété de mécanismes, y compris la protection, l’absorption, la réception sensorielle et la sécrétion. Les cellules épithéliales des reins jouent un rôle clé dans le stockage temporaire et la sécrétion ultérieure de matières excrétrices.
La culture de cellules rénales canines de Madin-Darby présentées dans l’image numérique ci-dessus a été marquée avec du DAPI et Alexa Fluor 568 conjugués à la phalloïdine, qui ciblent l’ADN dans le noyau cellulaire et le réseau cytosquelettique de la F-actine, respectivement. De plus, les cellules ont été transfectées avec un vecteur de localisation subcellulaire du plasmide chimérique pEYFP-Mitochondries (protéine fluorescente jaune améliorée). Les images ont été enregistrées en niveaux de gris avec un système de caméra Qimaging Retiga Fast-EXi couplé à un microscope Olympus BX-51 équipé de blocs optiques de filtre à fluorescence d’émission passe-bande fournis par Omega Optical. Au cours de l’étape de traitement, des canaux d’image individuels ont été pseudocolorés avec des valeurs RVB correspondant à chacun des profils spectraux d’émission de fluorophores.
Images de fluorescence supplémentaires de Cellules Rénales Canines de Madin-Darby (MDCK)
Des cellules épithéliales MDCK avec CMXRos Rouge MitoTracker, Alexa Fluor 488 et DAPI – Une culture adhérente de cellules rénales canines de Madin-Darby a été marquée pour le réseau mitochondrial intracellulaire et pour l’actine filamenteuse avec CMXRos Rouge MitoTracker et Alexa Fluor 488 conjuguées à la phalloïdine, respectivement. La sonde absorbant les ultraviolets DAPI a été utilisée pour contrer la coloration de l’ADN.
![]()
Ciblant les Peroxysomes et les protéines de Clathrine dans les cellules rénales de Madin-Darby avec Immunofluorescence – Dans cette section, la culture décrite de cellules MDCK a été marquée de manière immunofluorescente avec des anticorps monoclonaux primaires anti-clathrine (chaîne lourde) de souris suivis de fragments Fab anti-souris de chèvre conjugués au colorant cyanine Cy3 afin de cibler le réseau cytosquelettique. De plus, les peroxysomes présents dans la culture ont été marqués immunofluorescemment avec du Cy2 conjugué à des anticorps secondaires de chèvre dirigés contre des anticorps primaires anti-PMP 70 (protéine membranaire peroxysomique 70) de lapin. Les noyaux ont été contre-colorés avec Hoechst 33342.
![]()
Localisation subcellulaire améliorée de la protéine jaune des Mitochondries dans des cultures de cellules MDCK – Une culture de cellules épithéliales rénales canines de Madin-Darby a été transfectée avec un vecteur de localisation subcellulaire du plasmide chimérique pEYFP-Mitochondries (protéine fluorescente jaune améliorée). Les cellules ont également été colorées avec SYTOX Orange et Alexa Fluor 350 conjuguées à la phalloïdine, ciblant respectivement l’ADN et le réseau d’actine filamenteuse cytosquelettique.
![]()
Le ciblage par immunofluorescence des Histones et du Complexe de Golgi dans des cultures de cellules épithéliales rénales canines – Les cellules rénales canines de Madin-Darby ont été fixées avec du paraformaldéhyde, perméabilisées et traitées avec un mélange d’anticorps primaires de lapin (anti-giantin) et de souris (anti-histones; pan), suivis d’anticorps secondaires conjugués à Alexa Fluor 488 et Texas Red, respectivement. Le cocktail d’anticorps secondaire contenait également Alexa Fluor 350 conjugué à la phalloïdine, conçu pour cibler simultanément le réseau d’actine filamenteuse.
![]()
Double Immunofluorescence de Protéines Complexes de Pores Nucléaires et de Jonctions serrées dans les cellules rénales Canines de Madin-Darby – Des jonctions serrées de cellules épithéliales et des protéines complexes de pores nucléaires ont été imagées simultanément dans des cellules MDCK avec un cocktail d’anticorps primaires anti-NPCP de souris et anti-ZO-3 de lapin, suivis d’anticorps secondaires anti-souris de chèvre et anti-lapin conjugués respectivement à Alexa Fluor 488 et Alexa Fluor 568.
![]()
Le réseau mitochondrial dans les cellules MDCK – Une culture monocouche adhérente de cellules rénales canines de Madin-Darby a été marqué de manière immunofluorescente avec des anticorps primaires de la protéine inhibitrice du complexe V anti-oxphos de souris, suivis de fragments Fab anti-souris de chèvre conjugués à la fluorescéine. La culture a ensuite été colorée avec Alexa Fluor 568 conjuguée à la phalloïdine pour révéler les détails du réseau d’actine filamenteuse, et DAPI pour l’ADN dans le noyau.
![]()
Les cellules MDCK contenant des agglutinines-Lectines de germe de blé sont une classe spécialisée de protéines végétales qui se lient à des groupes glucidiques spécifiques attachés aux protéines ou résidant dans les membranes cellulaires. Membre éminent de ce groupe, l’agglutinine de germe de blé est souvent utilisée pour localiser le complexe de Golgi dans les expériences de marquage par fluorescence. La culture illustrée dans cette section a été marquée avec de l’agglutinine de germe de blé conjuguée au Rouge Texas, ainsi qu’Alexa Fluor 488 conjuguée à la phalloïdine et au DAPI (ciblant l’ADN dans le noyau).
![]()
Ciblage des Mitochondries avec des Protéines fluorescentes dans des cultures de cellules Rénales Canines – Une culture semi-confluente de cellules MDCK a été transitoirement transfectée avec une chimère plasmidique contenant la séquence codante de la protéine fluorescente jaune améliorée (EYFP) fusionnée à la séquence de ciblage mitochondrial de la sous-unité VIII de la cytochrome C oxydase humaine. Après fixation et perméabilisation, les cellules ont été contre-colorées pour l’actine filamenteuse avec Alexa Fluor 546 conjuguée à la phalloïdine et pour l’ADN avec le colorant spécifique nucléaire, le DAPI.
![]()
Jonctions serrées dans des cultures de cellules rénales canines de Madin-Darby – La protéine de jonction serrée ZO-3 a été visualisée par immunofluorescence dans une culture confluente de cellules MDCK. Des anticorps anti-ZO-3 de lapin ciblant la protéine ont été marqués avec des fragments Fab secondaires chèvre-anti lapin conjugués au colorant cyanine, Cy3. Les noyaux ont été contre-colorés avec le fluorophore DAPI spécifique à l’ADN.
![]()
Cultures de cellules adhérentes au MDCK avec Texas Red, Alexa Fluor 488 et Alexa Fluor 350 – Dans une expérience de marquage à double immunofluorescence, une culture de cellules MDCK a été traitée avec un cocktail d’anticorps primaires anti-histones de souris (pan) et anti-PMP 70 de lapin (protéine membranaire peroxysomique). Les protéines cibles ont ensuite été visualisées avec des anticorps secondaires anti-souris de chèvre et anti-lapin conjugués à Texas Red et Alexa Fluor 488, respectivement. Le réseau cytosquelettique filamenteux d’actine a été contre-coloré avec Alexa Fluor 350 conjugué à la phalloïdine.
![]()
Schémas de coloration classiques dans les cellules épithéliales rénales canines – La combinaison désormais traditionnelle et populaire de CMXRos Rouge MitoTracker, Alexa Fluor 488 conjuguée à la phalloïdine et Hoechst 33342 a été utilisée pour marquer trois fois une culture adhérente de cellules MDCK. Notez le réseau d’actine filamenteux inhabituel et le grand nombre de mitochondries entourant les noyaux de ces cellules.
![]()
Localisation subcellulaire des Mitochondries avec des Protéines fluorescentes dans les cellules MDCK – Après fixation et perméabilisation, la culture des cellules MDCK présentées dans cette section a été marquée avec de l’iodure de propidium et de l’Alexa Fluor 350 conjugués à la phalloïdine, qui ciblent respectivement l’ADN et l’actine filamenteuse. De plus, les cellules ont d’abord été transfectées avec un vecteur de localisation subcellulaire du plasmide pEYFP-Mitochondrie, localisant ainsi une étiquette de protéine fluorescente jaune sur le réseau mitochondrial intracellulaire.
![]()
Le vaste réseau de Tubulines dans les Cellules Épithéliales-Microtubules du Rein canin de Madin-Darby a été coloré par immunofluorescence en traitant une culture fixe et perméabilisée de cellules MDCK avec des anticorps primaires anti-alpha-tubuline de souris suivis d’anticorps anti-souris de chèvre conjugués à Alexa Fluor 568. Les noyaux ont été contre-colorés avec du vert SYTOX. Bien que non imagée dans cette section, la culture a également été étiquetée avec Alexa Fluor 350 conjuguée à la phalloïdine.
![]()
Visualisation simultanée de la Clathrine, des Peroxysomes et des Noyaux dans des cultures de cellules MDCK – La culture de cellules MDCK présentée dans cette section a été marquée de manière immunofluorescente avec des anticorps monoclonaux primaires anti-clathrine (chaîne lourde) de souris suivis de fragments Fab anti-souris de chèvre conjugués au colorant cyanine Cy3 afin de cibler le réseau cytosquelettique. De plus, les peroxysomes présents dans la culture ont été marqués immunofluorescemment avec du Cy2 conjugué à des anticorps secondaires de chèvre dirigés contre des anticorps primaires anti-PMP 70 (protéine membranaire peroxysomique 70) de lapin. Les noyaux ont été contre-colorés avec Hoechst 33342.
![]()
Le réseau de filaments intermédiaires de cytokératine dans les cellules épithéliales du rein canin – La cytokératine est un composant commun et abondant du réseau de filaments intermédiaires dans les cellules épithéliales. La culture adhérente de cette section a été marquée par immunofluorescence avec des anticorps primaires anti-cytokératine (pan) de souris, suivis d’anticorps secondaires anti-souris de chèvre conjugués au bleu Marina. Les mitochondries ont été visualisées avec des CMXRos Rouge MitoTracker et les noyaux ont été colorés avec du vert SYTOX.
![]()
Cellules rénales canines de Madin-Darby avec Alexa Fluor 488, Alexa Fluor 568 et Hoechst 33258 – La localisation simultanée des jonctions serrées et des protéines du complexe de pores nucléaires (NPCP) a été réalisée avec une expérience de double immunofluorescence avec des cellules MDCK utilisant des anticorps primaires anti-NPCP de souris et anti-ZO-3 de lapin. Les cibles subcellulaires ont été visualisées à l’aide d’anticorps secondaires anti-souris de chèvre et anti-lapin (IgG) conjugués à Alexa Fluor 488 et Alexa Fluor 568, respectivement. L’ADN dans les noyaux a été contre-coloré à l’aide de Hoechst 33258.
![]()
Marquage immunofluorescent du réseau mitochondrial dans des cultures de cellules MDCK – Les cellules rénales canines de Madin-Darby ont été marquées de manière immunofluorescente avec des anticorps primaires de la protéine inhibitrice du complexe V anti-oxphos de souris, suivis de fragments Fab anti-souris de chèvre conjugués à la fluorescéine. La culture a ensuite été colorée avec Alexa Fluor 568 conjuguée à la phalloïdine pour révéler les détails du réseau d’actine filamenteuse, et DAPI pour l’ADN dans le noyau.
![]()
CMXRos Rouges MitoTracker, Cy2 et Hoechst 33258 dans des cellules rénales canines de Madin-Darby – Une culture adhérente fixe et perméabilisée de cellules rénales canines de Madin-Darby a été marquée par immunofluorescence avec des anticorps anti-cytokératine primaires de souris, suivis de fragments Fab anti-souris de chèvre conjugués au colorant cyanine, Cy2. Avant la fixation, la culture a été traitée pendant une heure avec des CMXRos rouges MitoTracker, et après les traitements par anticorps, les noyaux ont été contre-colorés avec Hoechst 33258.
![]()
Liaison des Lectines au Complexe de Golgi dans les cultures de cellules épithéliales MDCK – Afin de visualiser la liaison de la lectine au complexe de Golgi dans les cellules MDCK, une culture adhérente a été traitée avec de l’agglutinine de germe de blé conjuguée au vert d’Oregon. Les cellules ont ensuite été contre-colorées avec Alexa Fluor 568 conjuguée à la phalloïdine pour localiser le réseau d’actine filamenteuse, et la tache d’acide nucléique DAPI pour marquer l’ADN dans le noyau.
![]()
Des cellules MDCK adhérentes avec des colorants Alexa Fluor 488, Alexa Fluor 568 et Hoechst 33342-Alexa Fluor ont été utilisées pour visualiser la distribution de la clathrine et de la protéine membranaire peroxysomique 70 (PMP 70) dans une culture de cellules épithéliales rénales canines de Madin-Darby. Après les réactions d’immunofluorescence, les cellules ont été contre-colorées avec Hoechst 33342 pour révéler l’emplacement des noyaux.
![]()
Cellules rénales canines de Madin-Darby avec CMXRos Rouge MitoTracker, Alexa Fluor 488 et DAPI – L’une des combinaisons de fluorophores les plus utiles pour visualiser les détails cellulaires internes comprend les CMXRos Rouge MitoTracker pour cibler les mitochondries, Alexa Fluor 488 conjuguée à la phalloïdine pour le réseau d’actine filamenteuse, et DAPI pour localiser les noyaux.
![]()
Visualisation des réseaux cytosquelettiques des Microtubules et de l’Actine dans les cultures de cellules MDCK – Afin de visualiser simultanément les réseaux d’actine et de tubuline dans les cellules MDCK, une culture fixe et perméabilisée a été traitée avec des anticorps primaires anti-alpha-tubuline de souris, suivis d’un cocktail d’anticorps secondaires anti-souris de chèvre conjugués à Alexa Fluor 568 mélangés avec Alexa Fluor 350 conjugués à la phalloïdine. Les noyaux ont été contre-colorés avec du vert SYTOX.
![]()
Double Immunofluorescence de Protéines Complexes de Pores Nucléaires et de Jonctions serrées dans les cellules rénales Canines de Madin-Darby – Des jonctions serrées de cellules épithéliales et des protéines complexes de pores nucléaires ont été imagées simultanément dans des cellules MDCK avec un cocktail d’anticorps primaires anti-NPCP de souris et anti-ZO-3 de lapin, suivis d’anticorps secondaires anti-souris de chèvre et anti-lapin conjugués respectivement à Alexa Fluor 568 et Alexa Fluor 488. Les noyaux ont été contre-colorés avec Hoechst 33258.
![]()
Proximité du Noyau et du complexe de Golgi dans des cultures de cellules MDCK monocouches – La proximité entre le complexe de Golgi et les noyaux dans les cellules rénales canines de Madin-Darby a été sondée dans une expérience de double immunofluorescence avec des anticorps primaires anti-NPCP (nuclear pore complex protein) de souris et anti-giantin (complexe de Golgi) de lapin. Les cibles d’anticorps ont été visualisées avec des anticorps secondaires de chèvre conjugués à Alexa Fluor 568 et Alexa Fluor 488, respectivement, tandis que le cadre cytosquelettique de l’actine a été marqué avec Alexa Fluor 350 conjugué à la phalloïdine.
RETOUR À LA GALERIE DE FLUORESCENCE DES CELLULES CULTIVÉES
RETOUR À LA GALERIE DE FLUORESCENCE
Questions ou commentaires? Envoyez-nous un email.
© 1998-2021 par Michael W. Davidson et l’Université d’État de Floride. Tous Droits réservés. Aucune image, graphique, script ou applets ne peut être reproduit ou utilisé de quelque manière que ce soit sans l’autorisation des détenteurs des droits d’auteur. L’utilisation de ce site Web signifie que vous acceptez toutes les Conditions légales énoncées par les propriétaires.
Ce site Web est maintenu par notre Équipe de Programmation Web
Graphique &en collaboration avec la Microscopie Optique au Laboratoire National de Champ Magnétique Élevé
.
Dernière modification : Vendredi 13 Novembre 2015 à 14h19
Nombre d’accès Depuis Juillet 16, 2004: 79076
Microscopes, filtres à fluorescence et équipement d’imagerie numérique fournis par :
![]()
![]()
![]()