- Cyfrowa Galeria Zdjęć fluorescencyjnych
- komórki nabłonka nerki psa Madin-Darby (linia MDCK)
- dodatkowe obrazy fluorescencyjne komórek nerki psów Madin-Darby (MDCK)
- pytania lub komentarze? Wyślij do nas e-mail.
- © 1998-2019 autorstwa Michaela W. Davidsona i Florida State University. Wszelkie Prawa Zastrzeżone. Żadne obrazy, grafiki, skrypty ani aplety nie mogą być powielane ani wykorzystywane w jakikolwiek sposób bez zgody właścicieli praw autorskich. Korzystanie z tej strony oznacza, że zgadzasz się na wszystkie warunki prawne określone przez właścicieli.
- ta strona jest utrzymywana przez naszzespół grafików & programistów internetowychwe współpracy z mikroskopią optyczną wNational High Magnetic Field Laboratory.
- Ostatnia modyfikacja: piątek, 13 lis 2015 o 02:19 PM
- Liczba dostępu od lipca 16, 2004: 79076
- Mikroskopy, filtry fluorescencyjne i sprzęt do cyfrowego obrazowania dostarczane przez:
Cyfrowa Galeria Zdjęć fluorescencyjnych
komórki nabłonka nerki psa Madin-Darby (linia MDCK)
uzyskane przez S. H. Madina i N. B. Darby ’ ego z tkanki nerkowej dorosłej samicy cocker spaniela, linia komórkowa MDCK powstała we wrześniu 1958 roku. Od tego czasu komórki były szeroko wykorzystywane do badania przetwarzania białka prekursorowego beta-amyloidu, a także sortowania jego produktów proteolitycznych.
morfologia linii komórkowej MDCK jest nabłonkowa, a komórki są dodatnie dla keratyny przez zabarwienie immunoperoksydazy. Wirusy, na które komórki MDCK są podatne, obejmują pęcherzykowe zapalenie jamy ustnej (szczep Indiana), krowiankę, coxsackievirus B5, reowirus 2 i 3, adenowirus 4 i 5, pęcherzykowe wykwity świń i zakaźne psie zapalenie wątroby. Komórki wykazują oporność na coxsackiewirusy B3 i B4 oraz poliowirusy 2 i są ujemne dla odwrotnej transkryptazy.
linia MDCK jest powszechnie stosowana jako ogólny model dla komórek nabłonkowych, które zawierają typ tkanki znany jako nabłonek. Głównie znaleźć obejmujące narządy wewnętrzne i inne powierzchnie ciała, nabłonek składa się z ciasno upakowanych komórek, które są zorganizowane w arkusze. Komórki te wydzielają macierz pozakomórkową zwaną podstawową laminą u ich podstawy, która pomaga zakotwiczyć tkankę nabłonkową w sąsiednich tkankach. Komórki nabłonkowe również nie mają bezpośredniego dostępu do naczyń krwionośnych i dlatego muszą uzyskać tlen i składniki odżywcze poprzez dyfuzję, w taki sam sposób, w jaki są zmuszone do pozbycia się produktów przemiany materii. Nabłonek działa w różnych mechanizmach, w tym w ochronie, absorpcji, odbiorze sensorycznym i wydzielaniu. Komórki nabłonkowe nerek odgrywają kluczową rolę w czasowym przechowywaniu, a następnie wydzielaniu materiałów wydalniczych.
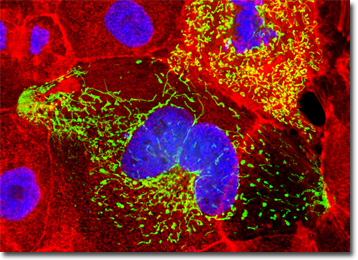
kultury komórek nerek psów Madin-Darby przedstawione na powyższym obrazie cyfrowym oznaczono DAPI i Alexa Fluor 568 sprzężonymi z falloidyną, które celują odpowiednio w DNA w jądrze komórkowym i w sieć cytoszkieletową f-aktyny. Ponadto komórki transfekowano mitochondriami pEYFP (ulepszone żółte białko fluorescencyjne)chimerycznym plazmidem subkomórkowym wektorem lokalizacji. Obrazy były rejestrowane w skali szarości za pomocą systemu kamer Qimaging Retiga Fast-EXi połączonego z mikroskopem Olympus BX-51 wyposażonym w bloki optyczne z filtrem fluorescencji emisyjnej bandpass firmy Omega Optical. Na etapie przetwarzania poszczególne kanały obrazu były pseudokolorowane wartościami RGB odpowiadającymi każdemu z profili widmowych emisji fluoroforów.
dodatkowe obrazy fluorescencyjne komórek nerki psów Madin-Darby (MDCK)
komórki nabłonkowe MDCK z MitoTracker Red CMXRos, Alexa Fluor 488 i dapi-adherentną kulturą komórek nerek psów Madin-Darby oznaczono odpowiednio dla wewnątrzkomórkowej sieci mitochondrialnej i dla aktyny nitkowatej z Mitotracker Red CMXRos i Alexa Fluor 488 sprzężonych z falloidyną. Sonda absorbująca promieniowanie ultrafioletowe dapi została wykorzystana do przeciwstawienia DNA.
![]()
celowanie Peroksysomami i białkami Klatryny w komórki nerek Madin-Darby z Immunofluorescencją – w tej sekcji, opisywana hodowla komórek MDCK była immunofluorescencyjnie znakowana pierwotnymi mysimi przeciwciałami monoklonalnymi przeciw klatrynie (łańcuch ciężki), a następnie kozie fragmenty Fab anty-mysie skoniugowane do cyjaninowego barwnika Cy3 w celu ukierunkowania na sieć cytoszkieletu. Dodatkowo, peroksysomy obecne w hodowli były immunofluorescencyjnie znakowane Cy2 sprzężonymi z kozimi przeciwciałami wtórnymi skierowanymi przeciwko pierwotnym przeciwciałom anty-PMP 70 królika (peroksysomal membrane protein 70). Jądra zostały kontrastowane za pomocą Hoechst 33342.
![]()
ulepszona Subkomórkowa lokalizacja mitochondriów z żółtego białka w hodowlach komórek MDCK-kulturę komórek nabłonkowych nerki Madina-Darby ’ ego transfekowano mitochondriami pEYFP (ulepszone żółte białko fluorescencyjne) chimeryczny plazmid subkomórkowy wektor lokalizacji. Komórki zostały również zabarwione SYTOX Orange i Alexa Fluor 350 skoniugowane do falloidiny, celując odpowiednio w DNA i sieć cytoszkieletowej nitkowatej aktyny.
![]()
Immunofluorescencja ukierunkowana na histony i kompleks Golgiego w hodowlach komórek nabłonkowych nerek psów – komórki nerek psów Madin-Darby utrwalano paraformaldehydem, przenikano i traktowano mieszaniną pierwotnych przeciwciał królika (anty-giantin) i myszy (anty-histony; pan), a następnie przeciwciała wtórne skoniugowane odpowiednio do Alexa Fluor 488 i Texas red. Drugorzędowy koktajl przeciwciałowy zawierał również Alexa Fluor 350 skoniugowany z falloidyną, zaprojektowany w celu jednoczesnego ukierunkowania na sieć nitkowatej aktyny.
![]()
Podwójna Immunofluorescencja nuklearnych białek kompleksowych porów i ciasnych połączeń w komórkach nerek psów Madin-Darby-szczelne połączenia komórek nabłonka i jądrowe białka kompleksowych porów zostały jednocześnie zobrazowane w komórkach MDCK za pomocą koktajlu pierwotnych przeciwciał anty-npcp myszy i królika anty-ZO-3, a następnie wtórnych przeciwciał anty-myszy i anty-królika skoniugowanych odpowiednio do Alexa Fluor 488 i Alexa Fluor 568.
![]()
sieć mitochondrialna w komórkach MDCK-adherentnej monowarstwowej hodowli komórek nerki psów Madin-Darby była immunofluorescencyjnie znakowana pierwotnymi przeciwciałami białkowymi inhibitora kompleksu V-oxphos myszy, a następnie kozie fragmenty Fab-myszy sprzężone z fluoresceiną. Kultura została następnie zabarwiona Alexa Fluor 568 sprzężoną z falloidiną, aby ujawnić szczegóły sieci nitkowatej aktyny i DAPI dla DNA w jądrze.
![]()
komórki MDCK z kiełkami pszenicy aglutyniny – lektyny są wyspecjalizowaną klasą białek roślinnych, które wiążą się ze specyficznymi grupami węglowodanowymi przyłączonymi do białek lub przebywającymi w błonach komórkowych. Wybitny członek tej grupy, aglutynina z kiełków pszenicy jest często używana do lokalizacji kompleksu Golgiego w eksperymentach z etykietowaniem fluorescencyjnym. Kultura przedstawiona w tym rozdziale została oznaczona aglutyniną z kiełków pszenicy sprzężoną z czerwienią Teksasu, a także Alexa Fluor 488 sprzężoną z falloidiną i DAPI (ukierunkowaną na DNA w jądrze).
![]()
ukierunkowanie na Mitochondria za pomocą białek fluorescencyjnych w hodowlach komórek nerek psów – półpełną hodowlę komórek MDCK transfekowano przejściowo plazmidową chimerą zawierającą sekwencję kodującą dla ulepszonego żółtego białka fluorescencyjnego (eyfp) połączoną z mitochondrialną sekwencją celującą z podjednostki VIII oksydazy ludzkiego cytochromu C. Po utrwaleniu i permeabilizacji komórki przeciwstawiono aktynie nitkowatej za pomocą Alexa Fluor 546 sprzężonej z falloidyną i DNA za pomocą specyficznego dla jądra barwnika dapi.
![]()
szczelne połączenia w hodowlach komórek nerki psów Madin-Darby – szczelne połączenie białka ZO-3 zostało zobrazowane przez immunofluorescencję w hodowli zbiegu komórek MDCK. Królicze przeciwciała anty-ZO-3 skierowane na białko zostały oznaczone wtórnymi fragmentami Fab koziego i anty królika skoniugowanymi do cyjaniny, Cy3. Jądra przeciwstawiono specyficznym dla DNA FLUOROFOREM dapi.
![]()
hodowle komórek Adherentnych MDCK z czerwienią Teksasu, Alexa Fluor 488 i Alexa Fluor 350 – W Podwójnym eksperymencie znakowania immunofluorescencyjnego hodowlę komórek MDCK potraktowano koktajlem pierwotnych przeciwciał anty-histonów myszy (pan) i królika anty-PMP 70 (białko błonowe peroksysomalne). Białka docelowe wizualizowano następnie za pomocą wtórnych przeciwciał przeciwko myszom i królikom sprzężonych odpowiednio z Texas Red i Alexa Fluor 488. Nitkowatą sieć cytoszkieletową aktyny przeciwstawiono za pomocą Alexa Fluor 350 sprzężonego z falloidyną.
![]()
klasyczne wzorce barwienia w komórkach nabłonka nerki psa-obecnie tradycyjna i popularna kombinacja czerwonych CMXRos MitoTracker, Alexa Fluor 488 sprzężona z falloidiną i Hoechst 33342 została użyta do potrójnego oznaczania przylegającej kultury komórek MDCK. Zwróć uwagę na niezwykłą sieć nitkowatej aktyny i dużą liczbę mitochondriów otaczających jądra w tych komórkach.
![]()
Subkomórkowa lokalizacja mitochondriów z białkami fluorescencyjnymi w komórkach MDCK-po utrwaleniu i permeabilizacji, hodowlę komórek MDCK przedstawioną w tej sekcji oznaczono jodkiem propidium i Alexa Fluor 350 sprzężonymi z falloidyną, które celują odpowiednio w DNA i aktynę nitkowatą. Ponadto komórki najpierw transfekowano subkomórkowym wektorem lokalizacji plazmidu Peyfp-Mitochondria, lokalizując w ten sposób żółty fluorescencyjny znacznik białkowy do wewnątrzkomórkowej sieci mitochondrialnej.
![]()
rozległą sieć Tubulin w komórkach nabłonkowych nerki psów Madin-Darby – mikrotubule barwiono za pomocą immunofluorescencji, traktując stałą i permeabilizowaną hodowlę komórek MDCK pierwotnymi przeciwciałami mysimi anty-Alfa-tubulin, a następnie przeciwciałami kozimi anty-mysimi skoniugowanymi do Alexa Fluor 568. Jądra były kontrastowane z SYTOX Green. Chociaż nie przedstawiono tego w tej sekcji, kultura została również oznaczona za pomocą Alexa Fluor 350 sprzężonego z falloidyną.
![]()
jednoczesna Wizualizacja Klatryny, peroksysomów i jąder w hodowlach komórek MDCK-hodowla komórek MDCK przedstawiona w tej sekcji była immunofluorescencyjnie znakowana pierwszorzędowymi mysimi przeciwciałami monoklonalnymi przeciw klatrynie (łańcuch ciężki), a następnie kozimi fragmentami Fab anty-mysi skoniugowanymi z barwnikiem cyjaniny Cy3 w celu skierowania ich do sieci cytoszkieletowej. Ponadto, peroksysomy obecne w hodowli były immunofluorescencyjnie znakowane Cy2 sprzężonymi z kozimi przeciwciałami wtórnymi skierowanymi przeciwko pierwotnym przeciwciałom anty-PMP 70 królika (peroksysomal membrane protein 70). Jądra zostały kontrastowane za pomocą Hoechst 33342.
![]()
sieć włókien pośrednich Cytokeratyny w komórkach nabłonkowych nerek psów – Cytokeratyna jest częstym i obfitym składnikiem sieci włókien pośrednich w komórkach nabłonkowych. Hodowlę adhezyjną w tej sekcji znakowano immunofluorescencyjnie pierwszorzędowymi przeciwciałami przeciw cytokeratynie myszy (pan), a następnie drugorzędowymi przeciwciałami przeciw myszy kozy skoniugowanymi do Marina Blue. Mitochondria wizualizowano za pomocą Mitotracker Red CMXRos, a jądra zabarwiono SYTOX Green.
![]()
Madin-Darby Canine Kidney Cells with Alexa Fluor 488, Alexa Fluor 568, and Hoechst 33258 – Simultaneous localization of tight junctions and the nuclear pore complex proteins (NPCP) was performed with a double immunofluorescence experiment with MDCK cells using mysi anty-Npcp and rabbit anty-ZO-3 primary niweczniki. Subkomórkowe cele wizualizowano za pomocą wtórnych przeciwciał przeciwko myszom i królikom (IgG) skoniugowanych odpowiednio do Alexa Fluor 488 i Alexa Fluor 568. DNA w jądrach zostało skontrastowane za pomocą Hoechst 33258.
![]()
Immunofluorescencyjne znakowanie sieci mitochondrialnej w hodowlach komórek MDCK – komórki nerek psów Madin-Darby były immunofluorescencyjnie znakowane pierwotnymi przeciwciałami białkowymi inhibitora kompleksu V-oxphos myszy, a następnie kozie fragmenty Fab-u myszy sprzężone z fluoresceiną. Kultura została następnie zabarwiona Alexa Fluor 568 sprzężoną z falloidiną, aby ujawnić szczegóły sieci nitkowatej aktyny i DAPI dla DNA w jądrze.
![]()
Mitotracker Red CMXRos, Cy2 i Hoechst 33258 w Madin-Darby Canine Kidney Cells – stała i permeabilizowana przylegająca hodowla komórek nerki Madin-Darby canine została immunofluorescencyjnie znakowana pierwotnymi przeciwciałami przeciw cytokeratynie myszy, a następnie kozie fragmenty Fab anty-myszy sprzężone z cyjanowym barwnikiem Cyjanowym, Cy2. Przed fiksacją hodowlę traktowano przez godzinę Czerwonym CMXRos MitoTracker, a po leczeniu przeciwciałami jądra przeciwstawiono Hoechst 33258.
![]()
Wiązanie lektyn z kompleksem Golgiego w hodowlach komórek nabłonkowych MDCK – w celu zobrazowania wiązania lektyny z kompleksem Golgiego w komórkach MDCK, przylegającą kulturę potraktowano aglutyniną z kiełków pszenicy skoniugowaną do Oregon Green. Komórki następnie przeciwstawiono za pomocą Alexa Fluor 568 sprzężonego z falloidyną w celu zlokalizowania sieci nitkowatej aktyny, a kwas nukleinowy zabarwiono DAPI w celu oznaczenia DNA w jądrze.
![]()
przylegające komórki MDCK z barwnikami Alexa Fluor 488, Alexa Fluor 568 i Hoechst 33342 – Alexa Fluor zastosowano do wizualizacji dystrybucji klatryny i nadtlenosomalnego białka błonowego 70 (PMP 70) w hodowli komórek nabłonkowych nerek psów Madin-Darby. Po reakcjach immunofluorescencyjnych komórki przeciwstawiono Hoechst 33342, aby ujawnić lokalizację jąder.
![]()
Madin-Darby Canine Kidney Cells with MitoTracker Red CMXRos, Alexa Fluor 488, and DAPI-One of the most useful fluorophore combinations for visualizing internal cellular details includes Mitotracker Red CMXRos to target mitochondria, Alexa Fluor 488 conjugated to phalloidin for the nitamentous actin network, and dapi to localize the nuclei.
![]()
Wizualizacja sieci cytoszkieletu mikrotubuli i aktyny w hodowlach komórek MDCK-w celu jednoczesnej wizualizacji sieci aktyny i tubuliny w komórkach MDCK, utrwaloną i permeabilizowaną hodowlę potraktowano pierwszorzędowymi przeciwciałami anty-Alfa-tubuliny myszy, a następnie koktajl wtórnych przeciwciał anty-myszy kóz skoniugowanych do Alexa Fluor 568 zmieszanych razem z Alexa Fluor 350 skoniugowanych do falloidiny. Jądra były kontrastowane z SYTOX Green.
![]()
Podwójna Immunofluorescencja nuklearnych białek kompleksowych porów i ciasnych połączeń w komórkach nerek psów Madin-Darby ’ ego-szczelne połączenia komórek nabłonka i jądrowe białka kompleksowych porów zostały jednocześnie zobrazowane w komórkach MDCK za pomocą koktajlu pierwotnych przeciwciał anty-npcp myszy i królika anty-ZO-3, a następnie wtórnych przeciwciał anty-myszy i anty-królika sprzężonych odpowiednio z Alexa Fluor 568 i Alexa Fluor 488. Jądra zostały kontrastowane za pomocą Hoechst 33258.
![]()
bliskość jądra i kompleksu Golgiego w Monowarstwowych hodowlach komórek MDCK-bliskość między kompleksem Golgiego i jądrami w komórkach nerek psów Madin-Darby zbadano w podwójnym eksperymencie immunofluorescencyjnym z mysimi przeciwciałami anty-npcp (nuclear pore complex protein) i pierwotnymi przeciwciałami anty-giantin (Golgi complex) królika. Cele przeciwciał wizualizowano za pomocą wtórnych przeciwciał kozich skoniugowanych odpowiednio do Alexa Fluor 568 i Alexa Fluor 488, podczas gdy szkielet cytoszkieletu aktyny znakowano za pomocą Alexa Fluor 350 skoniugowanych do falloidiny.
powrót do galerii fluorescencji komórek hodowlanych
powrót do galerii fluorescencji
pytania lub komentarze? Wyślij do nas e-mail.
© 1998-2019 autorstwa Michaela W. Davidsona i Florida State University. Wszelkie Prawa Zastrzeżone. Żadne obrazy, grafiki, skrypty ani aplety nie mogą być powielane ani wykorzystywane w jakikolwiek sposób bez zgody właścicieli praw autorskich. Korzystanie z tej strony oznacza, że zgadzasz się na wszystkie warunki prawne określone przez właścicieli.
ta strona jest utrzymywana przez nasz
zespół grafików & programistów internetowych
we współpracy z mikroskopią optyczną w
National High Magnetic Field Laboratory.
Ostatnia modyfikacja: piątek, 13 lis 2015 o 02:19 PM
Liczba dostępu od lipca 16, 2004: 79076
Mikroskopy, filtry fluorescencyjne i sprzęt do cyfrowego obrazowania dostarczane przez:
![]()
![]()
![]()