- Fluoreszenz Digitale Bildergalerie
- Madin-Darby Canine Nierenepithelzellen (MDCK-Linie)
- Zusätzliche Fluoreszenzbilder von Madin-Darby Canine Kidney (MDCK) Zellen
- Fragen oder Anmerkungen? Senden Sie uns eine E-Mail.
- © 1998-2021 von Michael W. Davidson und der Florida State University. Alle Rechte vorbehalten. Keine Bilder, Grafiken, Skripte oder Applets dürfen ohne Genehmigung der Urheberrechtsinhaber reproduziert oder in irgendeiner Weise verwendet werden. Durch die Nutzung dieser Website erklären Sie sich mit allen von den Eigentümern festgelegten rechtlichen Bedingungen einverstanden.
- Diese Website wird von unseremGraphics & Webprogrammierteamin Zusammenarbeit mit Optical Microscopy amNational High Magnetic Field Laboratory gepflegt.
- Letzte Änderung: Freitag, 13.November 2015 um 02:19 Uhr
- Zugriffszahl seit Juli 16, 2004: 79076
- Mikroskope, Fluoreszenzfilter und digitale Bildgebungsgeräte bereitgestellt von:
Fluoreszenz Digitale Bildergalerie
Madin-Darby Canine Nierenepithelzellen (MDCK-Linie)
Abgeleitet von S. H. Madin und N. B. Darby aus dem Nierengewebe eines erwachsenen weiblichen Cocker Spaniels, entstand die MDCK-Zelllinie im September 1958. Seitdem wurden die Zellen in großem Umfang genutzt, um die Verarbeitung von Beta-Amyloid-Vorläuferproteinen sowie die Sortierung seiner proteolytischen Produkte zu untersuchen.
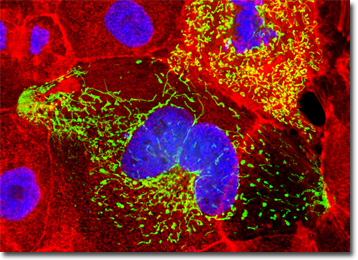
Die Morphologie der MDCK-Zelllinie ist epithelial und die Zellen sind durch Immunoperoxidase-Färbung positiv für Keratin. Viren, für die MDCK-Zellen anfällig sind, umfassen vesikuläre Stomatitis (Indiana-Stamm), Vaccinia, Coxsackievirus B5, Reovirus 2 und 3, Adenovirus 4 und 5, vesikuläres Exanthem von Schweinen und infektiöse Hunde-Hepatitis. Die Zellen zeigen Resistenzen gegen Coxsackievirus B3 und B4 sowie Poliovirus 2 und sind negativ für reverse Transkriptase.
Die MDCK-Linie wird üblicherweise als allgemeines Modell für Epithelzellen verwendet, die den als Epithel bekannten Gewebetyp umfassen. Hauptsächlich gefunden, die inneren Organe und andere Oberflächen des Körpers bedeckend, wird Epithel von dicht gepackten Zellen enthalten, die in Blätter organisiert werden. Diese Zellen sezernieren an ihrer Basis eine extrazelluläre Matrix, die Basallamina genannt wird, die hilft, das Epithelgewebe an benachbarten Geweben zu verankern. Epithelzellen haben auch keinen direkten Zugang zu Blutgefäßen und müssen daher Sauerstoff und Nährstoffe durch Diffusion erhalten, genauso wie sie gezwungen sind, sich von Stoffwechselabfällen zu befreien. Epithelien funktionieren in einer Vielzahl von Mechanismen, einschließlich Schutz, Absorption, sensorischer Rezeption und Sekretion. Die Epithelzellen der Nieren spielen eine Schlüsselrolle bei der vorübergehenden Speicherung und anschließenden Sekretion von Ausscheidungsmaterialien.
Die Kultur von Madin-Darby-Hunde-Nierenzellen, die im obigen digitalen Bild dargestellt sind, wurde mit DAPI und Alexa Fluor 568 markiert, die an Phalloidin konjugiert sind und auf DNA im Zellkern bzw. das F-Aktin-Zytoskelett-Netzwerk abzielen. Zusätzlich wurden die Zellen mit einem pEYFP-Mitochondrien (enhanced yellow fluorescent Protein) chimären Plasmid subzellulären Lokalisierungsvektor transfiziert. Die Bilder wurden in Graustufen mit einem QImaging Retiga Fast-EXi-Kamerasystem aufgenommen, das mit einem Olympus BX-51-Mikroskop gekoppelt war, das mit Bandpassemissionsfluoreszenzfilteroptikblöcken von Omega Optical ausgestattet war. Während der Verarbeitungsstufe wurden einzelne Bildkanäle mit RGB-Werten pseudogefärbt, die jedem der Fluorophoremissionsspektralprofile entsprachen.
Zusätzliche Fluoreszenzbilder von Madin-Darby Canine Kidney (MDCK) Zellen
MDCK-Epithelzellen mit MitoTracker Red CMXRos, Alexa Fluor 488 und DAPI – Eine adhärente Kultur von Madin-Darby-caninen Nierenzellen wurde für das intrazelluläre mitochondriale Netzwerk bzw. für filamentöses Aktin mit Mitotracker Red CMXRos und Alexa Fluor 488 markiert konjugiert an Phalloidin. Die ultraviolett-absorbierende Sonde DAPI wurde verwendet, um DNA gegenzufärben.
![]()
Targeting von Peroxisomen und Clathrinproteinen in Madin-Darby-Nierenzellen mit Immunfluoreszenz – In diesem Abschnitt wurde die vorgestellte Kultur von MDCK-Zellen immunfluoreszent mit primären monoklonalen Antikörpern gegen Clathrin (schwerkettige Maus) markiert, gefolgt von Ziegen-Anti-Maus-Fab-Fragmenten, die an den Cyaninfarbstoff Cy3 konjugiert waren, um das Zytoskelett-Netzwerk anzugreifen. Zusätzlich wurden Peroxisomen, die in der Kultur vorhanden waren, immunfluoreszent mit Cy2 markiert, das an Ziegen-Sekundärantikörper konjugiert war, die gegen Kaninchen-Anti-PMP 70 (Peroxisomal membrane Protein 70) -Primärantikörper gerichtet waren. Kerne wurden mit Hoechst 33342 gegengefärbt.
![]()
Enhanced Yellow Protein Subzelluläre Lokalisation von Mitochondrien in MDCK-Zellkulturen – Eine Kultur von Madin-Darby canine Nierenepithelzellen wurde mit einem pEYFP-Mitochondrien (enhanced yellow fluorescent Protein) chimären Plasmid subzellulären Lokalisierungsvektor transfiziert. Die Zellen wurden auch mit SYTOX Orange und Alexa Fluor 350 gefärbt, die an Phalloidin konjugiert waren und auf DNA bzw. das filamentöse Aktinnetzwerk des Zytoskeletts abzielten.
![]()
Immunfluoreszenz-Targeting der Histone und des Golgi-Komplexes in caninen Nierenepithelzellkulturen – Madin-Darby-canine Nierenzellen wurden mit Paraformaldehyd fixiert, permeabilisiert und mit einer Mischung aus Kaninchen- (Anti-Giantin) und Maus- (Anti-Histone; pan) Primärantikörpern behandelt, gefolgt von Sekundärantikörpern, die an Alexa Fluor 488 bzw. Texas Red konjugiert wurden. Der sekundäre Antikörpercocktail enthielt auch Alexa Fluor 350, das an Phalloidin konjugiert war und gleichzeitig auf das filamentöse Aktinnetzwerk abzielte.
![]()
Doppelte Immunfluoreszenz von Kernporenkomplexproteinen und Tight Junctions in Madin-Darby-caninen Nierenzellen – Epithelzellen-Tight Junctions und Kernporenkomplexproteine wurden gleichzeitig in MDCK-Zellen mit einem Cocktail aus Maus-Anti-NPCP- und Kaninchen-Anti-ZO-3-Primärantikörpern abgebildet, gefolgt von Ziegen-Anti-Maus- und Anti-Kaninchen-Sekundärantikörpern, die an Alexa Fluor 488 bzw. Alexa Fluor 568 konjugiert waren.
![]()
Das mitochondriale Netzwerk in MDCK-Zellen – Einer adhärenten Monolayer-Kultur von Madin-Darby-caninen Nierenzellen – wurde immunfluoreszent mit primären Maus-Anti-Oxphos-Komplex-V-Inhibitor-Protein-Antikörpern markiert, gefolgt von Ziegen-Anti-Maus-Fab-Fragmenten, die an Fluorescein konjugiert waren. Die Kultur wurde anschließend mit Alexa Fluor 568 angefärbt, das an Phalloidin konjugiert war, um Details des filamentösen Aktinnetzwerks und DAPI für DNA im Zellkern aufzudecken.
![]()
MDCK-Zellen mit Weizenkeim-Agglutinin – Lektinen sind eine spezialisierte Klasse von Pflanzenproteinen, die an spezifische Kohlenhydratgruppen binden, die an Proteine gebunden sind oder sich in Zellmembranen befinden. Ein prominentes Mitglied dieser Gruppe, Weizenkeimagglutinin, wird häufig verwendet, um den Golgi-Komplex in Fluoreszenzmarkierungsexperimenten zu lokalisieren. Die in diesem Abschnitt dargestellte Kultur wurde mit Weizenkeimagglutinin, konjugiert an Texas Red, sowie Alexa Fluor 488, konjugiert an Phalloidin und DAPI (Targeting DNA im Zellkern) markiert.
![]()
Targeting von Mitochondrien mit fluoreszierenden Proteinen in caninen Nierenzellkulturen – Eine semi-konfluente Kultur von MDCK-Zellen wurde transient mit einer Plasmidchimäre transfiziert, die die kodierende Sequenz für Enhanced Yellow Fluorescent Protein (EYFP) enthielt, die mit der mitochondrialen Targetingsequenz aus der Untereinheit VIII der humanen Cytochrom-C-Oxidase fusioniert war. Nach Fixierung und Permeabilisierung wurden die Zellen für filamentöses Aktin mit an Phalloidin konjugiertem Alexa Fluor 546 und für DNA mit dem kernspezifischen Farbstoff DAPI gegengefärbt.
![]()
Tight Junctions in Madin-Darby caninen Nierenzellkulturen – Das Tight Junction Protein ZO-3 wurde durch Immunfluoreszenz in einer konfluenten Kultur von MDCK-Zellen sichtbar gemacht. Kaninchen-Anti-ZO-3-Antikörper, die auf das Protein abzielten, wurden mit sekundären Fab-Fragmenten aus Ziegen-Anti-Kaninchen markiert, die an den Cyaninfarbstoff Cy3 konjugiert waren. Die Kerne wurden mit dem DNA-spezifischen Fluorophor DAPI gegengefärbt.
![]()
MDCK Adhärente Zellkulturen mit Texas Red, Alexa Fluor 488 und Alexa Fluor 350 – In einem Doppel-Immunfluoreszenz-Markierungsexperiment wurde eine Kultur von MDCK-Zellen mit einem Cocktail aus Maus-Anti-Histonen (pan) und Kaninchen-Anti-PMP 70 (peroxisomales Membranprotein) Primärantikörpern behandelt. Die Zielproteine wurden anschließend mit Ziegen-Anti-Maus- und Anti-Kaninchen-Sekundärantikörpern sichtbar gemacht, die an Texas Red bzw. Alexa Fluor 488 konjugiert waren. Das filamentöse Aktin-Zytoskelett-Netzwerk wurde mit Alexa Fluor 350, konjugiert an Phalloidin, gegengefärbt.
![]()
Klassische Färbemuster in caninen Nierenepithelzellen – Die heute traditionelle und beliebte Kombination aus MitoTracker Red CMXRos, Alexa Fluor 488 konjugiert an Phalloidin und Hoechst 33342 wurde verwendet, um eine adhärente Kultur von MDCK-Zellen dreifach zu markieren. Beachten Sie das ungewöhnliche filamentöse Aktinnetzwerk und die große Anzahl von Mitochondrien, die die Kerne in diesen Zellen umgeben.
![]()
Subzelluläre Lokalisation von Mitochondrien mit fluoreszierenden Proteinen in MDCK-Zellen – Nach Fixierung und Permeabilisierung wurde die in diesem Abschnitt vorgestellte Kultur von MDCK-Zellen mit Propidiumiodid und Alexa Fluor 350, konjugiert an Phalloidin, markiert, die auf DNA bzw. filamentöses Aktin abzielen. Zusätzlich wurden die Zellen zunächst mit einem subzellulären Lokalisierungsvektor des pEYFP-Mitochondrien-Plasmids transfiziert, wodurch ein gelb fluoreszierendes Protein-Tag an das intrazelluläre mitochondriale Netzwerk lokalisiert wurde.
![]()
Das ausgedehnte Tubulin-Netzwerk in Madin-Darby Canine Kidney Epithelial Cells – Mikrotubuli wurden mittels Immunfluoreszenz gefärbt, indem eine fixierte und permeabilisierte Kultur von MDCK-Zellen mit Maus-Anti-Alpha-Tubulin-Primärantikörpern behandelt wurde, gefolgt von Ziegen-Anti-Maus-Antikörpern, die an Alexa Fluor 568 konjugiert waren. Kerne wurden mit SYTOXGRÜN gegengefärbt. Obwohl in diesem Abschnitt nicht abgebildet, wurde die Kultur auch mit Alexa Fluor 350 markiert, das an Phalloidin konjugiert war.
![]()
Gleichzeitige Visualisierung von Clathrin, Peroxisomen und Kernen in MDCK-Zellkulturen – Die in diesem Abschnitt vorgestellte Kultur von MDCK-Zellen wurde immunfluoreszent mit primären monoklonalen Antikörpern gegen Clathrin (schwerkettige) Maus markiert, gefolgt von Ziegen-Anti-Maus-Fab-Fragmenten, die an den Cyaninfarbstoff Cy3 konjugiert wurden, um das Zytoskelett-Netzwerk anzugreifen. Darüber hinaus wurden in der Kultur vorhandene Peroxisomen immunfluoreszent mit Cy2 markiert, das an Ziegen-Sekundärantikörper konjugiert war, die gegen Kaninchen-Anti-PMP 70 (Peroxisomal membrane Protein 70) -Primärantikörper gerichtet waren. Kerne wurden mit Hoechst 33342 gegengefärbt.
![]()
The Cytokeratin Intermediate Filament Network in Canine Kidney Epithelial Cells – Cytokeratin ist eine häufige und reichlich vorhandene Komponente des intermediären Filamentnetzwerks in Epithelzellen. Die adhärente Kultur in diesem Abschnitt wurde immunfluoreszent mit Maus-Anti-Cytokeratin (pan) -Primärantikörpern markiert, gefolgt von Ziegen-Anti-Maus-Sekundärantikörpern, die an Marina Blue konjugiert waren. Mitochondrien wurden mit MitoTracker Red CMXRos visualisiert und die Kerne mit SYTOX Green gefärbt.
![]()
Madin-Darby Canine Kidney Cells mit Alexa Fluor 488, Alexa Fluor 568 und Hoechst 33258 – Simultane Lokalisierung von Tight Junctions und den Nuclear Pore complex Proteins (NPCP) wurde mit einem Doppel-Immunfluoreszenz-Experiment mit MDCK-Zellen unter Verwendung von Maus-Anti-NPCP- und Kaninchen-Anti-ZO-3-Primärantikörpern durchgeführt. Die subzellulären Targets wurden mit Ziegen-Anti-Maus- und Anti-Kaninchen-Sekundärantikörpern (IgG) sichtbar gemacht, die an Alexa Fluor 488 bzw. Alexa Fluor 568 konjugiert waren. DNA in den Kernen wurde mit Hoechst 33258 gegengefärbt.
![]()
Immunfluoreszierende Markierung des mitochondrialen Netzwerks in MDCK-Zellkulturen – Madin-Darby-canine Nierenzellen wurden immunfluoreszent mit primären Maus-Anti-Oxphos-Komplex-V-Inhibitor-Protein-Antikörpern markiert, gefolgt von Ziegen-Anti-Maus-Fab-Fragmenten, die an Fluorescein konjugiert waren. Die Kultur wurde anschließend mit Alexa Fluor 568 angefärbt, das an Phalloidin konjugiert war, um Details des filamentösen Aktinnetzwerks und DAPI für DNA im Zellkern aufzudecken.
![]()
MitoTracker Red CMXRos, Cy2, und Hoechst 33258 in Madin-Darby Canine Kidney Cells – Eine fixierte und permeabilisierte adhärente Kultur von Madin-Darby canine Kidney cells wurde immunfluoreszent mit primären Maus-Anti-Cytokeratin-Antikörpern markiert, gefolgt von Ziegen-Anti-Maus-Fab-Fragmenten, die an den Cyaninfarbstoff Cy2 konjugiert waren. Vor der Fixierung wurde die Kultur eine Stunde lang mit MitoTracker Red CMXRos behandelt und nach den Antikörperbehandlungen wurden die Kerne mit Hoechst 33258 gegengefärbt.
![]()
Bindung von Lektinen an den Golgi-Komplex in MDCK-Epithelzellkulturen – Um die Lektin-Bindung an den Golgi-Komplex in MDCK-Zellen sichtbar zu machen, wurde eine adhärente Kultur mit Weizenkeim-Agglutinin, konjugiert an Oregon Green, behandelt. Die Zellen wurden anschließend mit Alexa Fluor 568, das an Phalloidin konjugiert war, gegengefärbt, um das filamentöse Aktinnetzwerk zu lokalisieren, und die Nukleinsäurefärbung DAPI, um DNA im Kern zu markieren.
![]()
Adhärente MDCK-Zellen mit Alexa Fluor 488, Alexa Fluor 568 und Hoechst 33342 – Alexa Fluor-Farbstoffen wurden eingesetzt, um die Verteilung von Clathrin und dem peroxisomalen Membranprotein 70 (PMP 70) in einer Kultur von Madin-Darby caninen Nierenepithelzellen sichtbar zu machen. Nach den Immunfluoreszenzreaktionen wurden die Zellen mit Hoechst 33342 gegengefärbt, um die Lage der Kerne aufzudecken.
![]()
Madin-Darby Canine Nierenzellen mit MitoTracker Red CMXRos, Alexa Fluor 488 und DAPI – Eine der nützlichsten Fluorophorkombinationen zur Visualisierung interner zellulärer Details umfasst MitoTracker Red CMXRos für Mitochondrien, Alexa Fluor 488 konjugiert an Phalloidin für das filamentöse Aktinnetzwerk und DAPI zur Lokalisierung der Kerne.
![]()
Visualisierung der Mikrotubuli- und Aktin-Zytoskelett-Netzwerke in MDCK-Zellkulturen – Um gleichzeitig sowohl die Aktin- als auch die Tubulin-Netzwerke in MDCK-Zellen zu visualisieren, wurde eine fixierte und permeabilisierte Kultur mit primären Anti-Alpha-Tubulin-Antikörpern der Maus behandelt, gefolgt von einem Cocktail aus Ziegen-Anti-Maus-Sekundärantikörpern, die an Alexa Fluor 568 konjugiert waren, gemischt mit Alexa Fluor 350, das an Phalloidin konjugiert war. Kerne wurden mit SYTOXGRÜN gegengefärbt.
![]()
Doppelte Immunfluoreszenz von Kernporenkomplexproteinen und Tight Junctions in Madin-Darby-caninen Nierenzellen – Epithelzellen-Tight Junctions und Kernporenkomplexproteine wurden gleichzeitig in MDCK-Zellen mit einem Cocktail aus Maus-Anti-NPCP- und Kaninchen-Anti-ZO-3-Primärantikörpern abgebildet, gefolgt von Ziegen-Anti-Maus- und Anti-Kaninchen-Sekundärantikörpern, die an Alexa Fluor 568 bzw. Alexa Fluor 488 konjugiert waren. Kerne wurden mit Hoechst 33258 gegengefärbt.
![]()
Nähe des Kerns und des Golgi-Komplexes in Monolayer-MDCK-Zellkulturen – Die Nähe zwischen dem Golgi-Komplex und den Kernen in Madin-Darby-caninen Nierenzellen wurde in einem Doppel-Immunfluoreszenz-Experiment mit Maus-Anti-NPCP- (Nuclear Pore Complex Protein) und Kaninchen-Anti-Giantin- (Golgi-Komplex) Primärantikörpern untersucht. Die Antikörperziele wurden mit Ziegensekundärantikörpern sichtbar gemacht, die an Alexa Fluor 568 bzw. Alexa Fluor 488 konjugiert waren, während das Aktinzytoskelettgerüst mit Alexa Fluor 350 markiert war, das an Phalloidin konjugiert war.
ZURÜCK ZUR FLUORESZENZGALERIE FÜR KULTIVIERTE ZELLEN
ZURÜCK ZUR FLUORESZENZGALERIE
Fragen oder Anmerkungen? Senden Sie uns eine E-Mail.
© 1998-2021 von Michael W. Davidson und der Florida State University. Alle Rechte vorbehalten. Keine Bilder, Grafiken, Skripte oder Applets dürfen ohne Genehmigung der Urheberrechtsinhaber reproduziert oder in irgendeiner Weise verwendet werden. Durch die Nutzung dieser Website erklären Sie sich mit allen von den Eigentümern festgelegten rechtlichen Bedingungen einverstanden.
Diese Website wird von unserem
Graphics & Webprogrammierteam
in Zusammenarbeit mit Optical Microscopy am
National High Magnetic Field Laboratory gepflegt.
Letzte Änderung: Freitag, 13.November 2015 um 02:19 Uhr
Zugriffszahl seit Juli 16, 2004: 79076
Mikroskope, Fluoreszenzfilter und digitale Bildgebungsgeräte bereitgestellt von:
![]()
![]()
![]()