Finegoldia magna ist ein streng anaerober grampositiver Steißbein, der Teil der Kommensalflora der Haut, der Mundhöhle, des Gastrointestinaltrakts und des weiblichen Urogenitaltrakts ist.1,2 Wir beschreiben einen ungewöhnlichen Fall eines komplizierten Gesäßabszesses, der ausschließlich durch einen opportunistischen Erreger bei einem Patienten mit Diabetes mellitus verursacht wurde, der zuvor keine intramuskulären Injektionen in das betroffene Gebiet erhalten hatte.
Ein 60-jähriger Mann kam mit starken Schmerzen und Eiterungen im linken Gesäß, die 2 Wochen zuvor begonnen hatten, in die Notaufnahme. Die Vorgeschichte des Patienten umfasste Bluthochdruck, Dyslipidämie, Übergewicht (Body-Mass-Index, 29), Vitiligo, aktives Rauchen (20 Zigaretten pro Tag) und Typ-2-Diabetes mellitus von 12 Jahren Dauer mit guter Blutzuckerkontrolle ohne Anzeichen von metadiabetischen Komplikationen (HbA1, 7%), obwohl er in den letzten Wochen eine Verschlechterung der Blutzuckerkontrolle zu Hause berichtete, die mit dem Infektionsprozess zusammenfiel. Der Patient berichtete über keine vorherigen intramuskulären glutealen Injektionen. Er wurde mit Acetylsalicylsäure (100 mg/24 h), Atorvastatin (10 mg/24 h), Glimepirid (2 mg/24 h) und Bisoprolol (5 mg / 24 h) behandelt.
Die körperliche Untersuchung ergab eine große, schmerzhafte, heiß schwankende Schwellung des linken Gesäßes, begleitet von Crepitus und aktiver Eiterung, und eine nekrotische Fläche von 10 cm (Abb. 1). Labortests ergaben Folgendes: Hämoglobin, 15 g / dl; Leukozyten; 10 870 mm3; Thrombozyten, 121 000 mm3; Prothrombinzeit, 16%; Glukose, 370 mg / dl; Harnstoff, 67 mg / dl; Kreatinin, 1,25 mg / dl; milchsäure 2 mmol/l; Procalcitonin, 1,19 ng/ml; C-reaktives Protein, 249 mg/l.
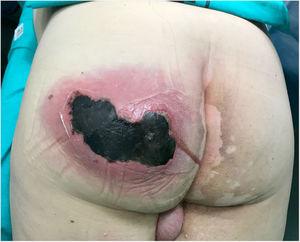
Abszess am linken Gesäß mit aktiver Eiterung und einem großen (10 cm) Nekrosebereich.
Aufgrund der klinischen Befunde wurde der Patient im Operationssaal einer Notdrainage unterzogen. Ein Liter Eiter wurde extrahiert, Proben zur Kultur entnommen und eine breite Exzision des nekrotischen Gewebes durchgeführt. Während der postoperativen Phase zeigte der Patient einen günstigen klinischen Verlauf, Wiederherstellung der Blutzuckerkontrolle und Mobilität und Funktionalität des linken Beines.
Abszesskulturen waren negativ für aerobe Bakterien und positiv nur für streng anaerobe grampositive Kokken, die Bakterientypisierung als F magna identifiziert. Ein Antibiogramm für F magna ergab eine Empfindlichkeit gegenüber Amoxicillin-Clavulansäure, Metronidazol und Clindamycin und keine Hinweise auf Antibiotikaresistenz. Der Patient wurde aus dem Krankenhaus entlassen und verschrieben Antibiotika-Behandlung (Metronidazol, 500 mg/ 8 h) und ambulante chirurgische Wundversorgung, auf die er gut ansprach.
F magna, früher bekannt als Peptostreptococcus magnus, hat seit seiner ersten Beschreibung im Jahr 1933 durch Prevot, der den Begriff Diplococcus magnus verwendete, mehrere taxonomische Veränderungen erfahren.3
F magna ist wahrscheinlich die häufigste aller grampositiven anaeroben Kokken (GPAC) und die pathogenste Form, die in menschlichen klinischen Proben gefunden wird. Dieser Mikroorganismus ist Teil der normalen Biota und kommt vorwiegend in der Haut, im Magen-Darm-Trakt, im weiblichen Urogenitaltrakt und in geringerem Maße in der Mundhöhle vor.1,2 In den letzten Jahren wurden 2 wichtige Proteine identifiziert, die die Virulenz und Kolonisationskapazität von F magna erklären: das Oberflächenadhäsionsprotein FAF (F magna Adhäsionsfaktor) und die subtilisinähnliche Serinprotease SufA.2,4 In den oberen Schichten der Epidermis vermittelt FAF die Adhäsion durch Bindung an Galectin-7, einen Keratinozyten-Zellmarker. In der Dermis interagiert FAF mit Kollagen V und Fibrillin, was vermutlich erklärt, wie F magna während einer Infektion die tiefsten Schichten des Hautgewebes erreichen kann.5
F magna ist eine der Arten, die am häufigsten aus Abszessen der Haut, Weichteile, Knochen und Gelenke kultiviert wird, normalerweise in polymikrobiellen Kulturen und in seltenen Fällen in Reinkulturen.3 Postoperative Mediastinitis, Endokarditis der Klappenprothese und nekrotisierende Pneumonie aufgrund von F magna wurden beschrieben.6 Die Verwendung von Breitbandantibiotika, die die Hautmikrobiota verändern, die Einführung von Fremdmaterialien (Klappenprothesen, Ersatzgelenke, Katheter) und eine Zunahme der Anzahl von Patienten, die mit Immunsuppressiva behandelt werden, begünstigen diese Infektionen, indem sie eine optimale Umgebung für diese opportunistischen Erreger schaffen.
Die Antibiotikaresistenz von anaeroben Bakterien nimmt weltweit zu.7 Die meisten GPACs (> 90%) sind anfällig für Penicillin, und viele sind auch anfällig für andere β-Lactam-Antibiotika, 7-10 zeigen jedoch eine zunehmende Resistenz gegen andere Antibiotika wie Clindamycin, Metronidazol und Fluorchinolone.8-10 Die Raten der Clindamycinresistenz bei GPACs liegen zwischen 7% und 20%, nehmen jedoch bei bestimmten Arten zu, einschließlich F Magna- und Peptoniphilus-Arten.7 Die meisten GPACs sind immer noch anfällig für Metronidazol, obwohl einige Metronidazol-resistente Stämme von F magna und Parvimonas micra beschrieben wurden.9
Der vorliegende Fall veranschaulicht, wie das Kommensalbakterium F magna in der Lage ist, eine fortgeschrittene nekrotisierende Infektion hervorzurufen, und unterstreicht die Bedeutung der Identifizierung und Bestimmung der antimikrobiellen Empfindlichkeit anaerober Bakterien auf Artenebene aus repräsentativen Proben, wenn sie in Reinkulturen isoliert werden.
Interessenkonflikte
Die Autoren erklären, dass sie keine Interessenkonflikte haben.