- Hypophosphorige Säure Chemische Eigenschaften, Verwendung, Produktion
- Gliederung
- Chemische Eigenschaften
- Verwendet
- Toxizität
- GEFAHRENKENNZEICHNUNG
- Zubereitungsmethode
- Herstellung methode
- Beschreibung
- Beschreibung
- Chemische Eigenschaften
- Physikalische Eigenschaften
- Verwendungen
- Definition
- Herstellung
- Herstellungsverfahren
- Definition
- Reaktionen
- Allgemeine Beschreibung
- Luft & Wasserreaktionen
- Reaktivitätsprofil
- Gefahr
- Gesundheitsgefahr
- Brandgefahr
- Reinigungsmethoden
Hypophosphorige Säure Chemische Eigenschaften, Verwendung, Produktion
Gliederung
Hypophosphorige Säure ist auch bekannt als „Hypophosphit“ Es ist farbloses Öl oder zerfließender Kristall, es ist ein wichtiges Feinchemikalienprodukt. Die Hauptverwendung ist als Reduktionsmittel für die stromlose Beschichtung, Phosphorsäure verhindern Verfärbung von Harzen, es kann auch in der Veresterungsreaktion Katalysator, das Kältemittel, insbesondere für die Herstellung von hochreinem Produkt Natriumhypophosphit verwendet werden. Es gibt einige Methoden für Vorbereitung, die allgemeine industrielle Methode für das Produzieren ist Ionenaustauscherharzmethode und Elektrodialyseverfahren.
Die chemischen Eigenschaften von hypophosphoriger Säure, Verwendungen, Toxizität und Produktionsmethoden werden von andy von Chemicalbook bearbeitet. (2016-12-04)
Chemische Eigenschaften
Es handelt sich um zerfließende Kristalle oder farbloses Öl. Schmelzpunkt: 26,5 ℃. Die relative Dichte (Dichte): 1,439 (Körper, 19℃). Es ist in Wasser, Ethanol und Ether löslich und kann in jedem Verhältnis mit Wasser, Ethanol und Aceton gemischt werden. In der Luft zerfällt es leicht zu sirupartiger Flüssigkeit, und die wässrige Lösung ist sauer.
Hypophosphorige Säure ist einbasige Säure, in wässriger Lösung ist Hypophosphorige Säure starke Säure, Ka = 10-2 (25 ℃); es ist relativ stabil bei Raumtemperatur; Disproportionierungsreaktion kann bei 130 ℃ ablaufen, zersetzen sich in Phosphin und phosphorige Säure:
2H3PO2 = H3PO4 + PH3
Es hat eine starke Reduktion, Schwermetallsalzlösung kann zu Metallen wie Cu2 +, Hg2 +, Ag +, wie:
4Ag + H3PO2 + 2H2) = 4Ag + H3PO4 + 4H +
Es ist schwach oxidationsmittel, es kann reduziert werden, um phosphin, phosphin wenn begegnungen starke reduktionsmittel.
Verwendet
1. Hypophosphorige Säure wird als Reduktionsmittel für die stromlose Beschichtung verwendet;
2. Es kann verwendet werden, um Verfärbung des Phosphorsäureharzes zu verhindern;
3. Es wird als Veresterungskatalysator, das Kältemittel verwendet;
4. Es wird verwendet, um Hypophosphit herzustellen, Natriumsalze, Mangansalze, Eisensalze werden im Allgemeinen als Nährstoffe verwendet;
5. Hypophosphorige Säure wird in der Medizin und als Reduktionsmittel, die Bestimmung von Arsen, Tellur und Trennung von Tantal, Niob und anderen Reagenzien verwendet.
6. Es ist ein starkes Reduktionsmittel, es kann zur Herstellung von Natriumhypophosphit, Calciumphosphat und anderem Hypophosphit verwendet werden.
7. Es kann für das Plattierungsbad verwendet werden. Pharma. Reduktionsmittel. allgemeine Reagenzien.
8. Es ist ein starkes Reduktionsmittel, es kann zur Herstellung von Natriumhypophosphit, Calciumphosphat und anderem Hypophosphit verwendet werden.
9. Dieses produkt ist weit verbreitet als reduktionsmittel, Ag, Cu, Ni, Hg und andere metalle sind reduziert, um die entsprechenden metall, für die überprüfung von Als, Nb, Ta und andere reagenzien, es kann verwendet werden für die herstellung von Na, K, Ca, Mn, Fe und andere arten von hypophosphit.
Toxizität
Es ist nicht brennbar. Aber wenn Kontakte mit dem Loch H Mittel, wird es Feuer verursachen. Wenn trifft oxidationsmittel, heftige reaktion und verbrennung kann gehen. Wenn es zu hoch erhitzt wird, kann es sich in hochgiftiges Phosphingas zersetzen oder sogar explodieren. Es ist ätzend. Hypophosphorige Säure wird oft in alkoholfreie Getränke gegeben, und weil es nicht absorbiert wird. So ist das Risiko gering, aber besonders stark Hypophosphit Magen-Darm verletzt. Versehentlich es spritzt in die augen oder kontakte haut, viel wasser ist verwendet zu gewaschen. Produktionsbetreiber sollten Schutzkleidung und andere Schutzkleidung tragen. Produktionsausrüstung sollte versiegelt werden, Werkstatt sollte gut gelüftet werden.
GEFAHRENKENNZEICHNUNG
Gefahrenhinweis:
Verursacht schwere Verätzungen der Haut und Augenschäden.
Verursacht schwere Augenschäden
Sicherheitshinweise:
Staub/Rauch/Gas/Nebel/Dämpfe/Spray nicht einatmen.
Nach Gebrauch gründlich waschen.
Schutzhandschuhe und Augen-/Gesichtsschutz tragen.
BEI VERSCHLUCKEN: Mund ausspülen. Kein Erbrechen herbeiführen.
BEI BERÜHRUNG MIT DER HAUT (oder DEM Haar): Alle kontaminierten Kleidungsstücke sofort ausziehen. Haut mit Wasser abspülen / duschen.
BEI KONTAKT MIT DEN AUGEN: Einige Minuten lang behutsam mit Wasser abspülen. Entfernen Sie Kontaktlinsen, wenn
vorhanden und einfach zu tun. Weiter spülen.
BEI EINATMEN: Opfer an die frische Luft bringen und in einer für das Atmen angenehmen Position ruhen lassen.
Sofort GIFTINFORMATIONSZENTRUM oder Arzt anrufen.
Laden gesperrt.
Entsorgen Sie dieses Material und seinen Behälter an einer Sammelstelle für gefährliche Abfälle oder Sondermüll.
Zubereitungsmethode
1. Phosphor- und Bariumhydroxidlösung wird erhitzt, Bariumsalz Ba (H2PO2) 2 • 2H2O kann erzeugen, Schwefelsäure wird in hypophosphorige saure Bariumlösung gegeben, Ba2 + kann ausfallen:
Ba (H2PO2) 2 + H2SO4 = BaSO4 + 2H3PO2
Hypophosphorige Säure kann durch Verdampfen unter vermindertem Druck und Niedertemperaturkristallisation erhalten werden. Da bei diesem Verfahren die Löslichkeit des Bariumsalzes gering ist, so dass die Konzentration der erhaltenen hypophosphorigen Säure nicht hoch ist, sollte das Produkt durch Umkristallisation gereinigt werden.
2. das Bariumoxid (oder Kalk) und die Lösung des weißen Phosphors werden zusammen erhitzt, um sekundäres Bariumphosphat (oder Kalzium) zu bilden, und reagieren dann mit Schwefelsäure, es wird filtriert, konzentriert, um Produkt zu erhalten, oder Natriumhypophosphitlösung, H-Ionenaustauscherharz kann Produkt ableiten. Diese methode erfordert eine große menge an harz, und harz regeneration und waschen schritt ist umständlich, es kostet in der regel mehr als $7 pro pfund, es ist nur geeignet für kleine charge produktion, und nicht geeignet für große industrielle anwendungen.
3. Hypophosphorige Säure wird durch Elektrodialyseverfahren hergestellt, wobei sich die Elektrodialysezelle in drei Teile teilt, sie sind Anodenkammer, Rohstoffkammer und Kathodenkammer, das Zwischenprodukt ist durch anionische Membran und kationische Membran getrennt, zwischen zwei Membranen wird Natriumhypophosphitlösung platziert (Konzentration von 100 g / L ~ 500 g / l), Anodenkammer ist verdünnte Lösung von hypophosphoriger Säure 5 g / l, Anodenkammer ist verdünnte Natriumhydroxidlösung (5 g / l), zwischen den Polen wird Gleichstrom (3 V ~ 36 V) geleitet, Anodenkammer ist verdünnte gibt Sauerstoff frei und erzeugt Sekundärprodukt der hypophosphorigen Säure; kathode emittiert wasserstoff, und erzeugt sekundäre produkt von natrium hydroxid, die reaktion zeit ist 3 ~ 21 h. die reaktionen von anode kammer und kathode kammer sind wie folgt:
anode kammer:
H2O = = H ++ OH-
2OH-= = O2 + 2H2O + 4e
H ++ H2PO2-= = H3PO2
kathode kammer:
H2O = = H ++ OH-
2H ++ 2e == H2
Na ++ OH-= = NaOH
Elektrodialyse methode der vorbereitung Hypophosphorige säure ist einfach und ausrüstung investition ist klein, es ist geeignet für massen produktion.
4. Ausgehend von dem industriellen Natriumhypophosphit werden Cl-, SO42-Anionen, die die Qualitätsindikatoren der hypophosphorigen Säure beeinflussen, durch Ausfällung entfernt, Schwermetallionen werden aus der Lösung durch Bildung von Sulfid entfernt und dann unter Verwendung von stark saurem Kationenaustauscherharz erhalten natriumsekundäres Phosphat, hochreines Produkt kann erhalten werden. Der Prozess kann hochwertiges sekundäres Phosphat produzieren, technisch ist durchführbar, der Prozess ist einfach, einfache Operation, gute Produktqualität, kann er den Bedarf der Elektronikindustrie, der Verteidigungsindustrie und anderer high-techer Felder erfüllen.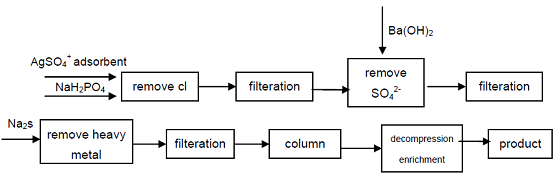
Abbildung 1 Herstellungsverfahren von hypophosphoriger Säure aus industriellem Natriumhypophosphit.
5. Ionenaustauscherharzmethode: ungefähr 70g des Kationenaustauscherharzes, das mit Wasser benetzt wird, wird in ein Glasrohr mit 5 mol/L Salzsäure verpackt, die ungefähr 15min, nachdem sie gänzlich mit Wasser gewaschen worden ist, wässrige Lösung des Natriumhypophosphits des hohen Reinheitsgrades (15 g/60 ml H2O) fließt durch sie, die Harzsäule wird zuerst mit 50 ml, dann mit destilliertem Wasser 25 rnl gewaschen zirkuliert. Die ablaufende Säure und das Waschen werden kombiniert, es wird durch Eindampfen im Wasserbad konzentriert. Die konzentrierte Säure wird im Hochvakuum mit P205 Trockner zur Dehydratisierung, Kühlung und Kristallisation, Filtration, Umkristallisation platziert, um hypophosphorige Säure Produkt zu erhalten.
Herstellung methode
Ionen austausch harz methode: setzen über 70g wasser-löslich kation austausch harze zu füllen in ein glas rohr. Mit 5 mol/L Salzsäure ca.15 min zirkulieren lassen und ausreichend mit Wasser waschen. Lassen Sie eine hohe wässrige Natriumhypophosphitlösung (15 g / 60 ml H2O) durch die Harzsäule fließen, gefolgt von zuerst mit 50 ml Wasser gewaschen und dann mit 25 rnl destilliertem Wasser gespült. Die ablaufende Säure und die Waschungen wurden vereinigt und auf einem Wasserbad eingedampft. Die konzentrierte Säure wird zur Dehydratisierung an den Hochvakuumtrockner P205 geschickt, gefolgt von Kühlkristallisation, Filtration und Umkristallisation, um das fertige Produkt aus hypophosphoriger Säure zu erhalten.
Beschreibung
Hypophosphorige Säure ist ein starkes Reduktionsmittel mit einer Summenformel von H3PO2. Anorganische Chemiker beziehen sich auf die freie Säure mit diesem Namen, obwohl ihr IUPACname Dihydridohydroxidooxidophosphor oder der akzeptable Name der Phosphinsäure ist. Es ist eine farblose, niedrigschmelzende Verbindung, die in Wasser, Dioxan und Alkoholen löslich ist. Die Formel für Hypophosphorsäuresäure wird im Allgemeinen geschrieben H3PO2, aber eine beschreibendere Darstellung ist HOP (O) H2, die hervorhebtsein monoprotischer Charakter. Salze, die von dieser Säure abgeleitet sindwerden Phosphinate (Hypophosphite) genannt.
Beschreibung
Diese säure hat die allgemeine formel ofH4P2O6 und differsfrom die andere oxy-phosphor säuren. Es hat viele peculiarities.It wird zusammen mit Phosphor und Phosphor gebildetsäuren, wenn Phosphor durch feuchte Luft oxidiert wird.Wenn weißer Phosphor der Luft ausgesetzt wird, und Natriumacetatwird der Flüssigkeit hinzugefügtwelches sich bildet, das etwas unlösliche Natriumhypophosphat,Na2H2P2O6·6H2Oseparates. Dasnatriumhypophosphat-Monohydrat ist jedoch bei ~ 98,7 g / 100 ml sehr löslich und zerfließend.
Chemische Eigenschaften
farblose Flüssigkeit
Physikalische Eigenschaften
Farblose zerfließende Kristalle oder ölige Flüssigkeit; saurer Geruch; Dichte 1,493 g/cm3; schmilzt bei 26,5 °C; siedet bei 130°C; sehr gut löslich in Wasser, Alkohol und Ether; Dichte einer 50% igen wässrigen Lösung beträgt 1,13 g/ml.
Verwendungen
Herstellung von Hypophosphiten, Galvanikbäder.
Definition
ChEBI: Eine Phosphoroxosäure, die aus einem einzigen fünfwertigen Phosphor besteht, der über Einfachbindungen kovalent an zwei Wasserstoffatome und eine Hydroxygruppe und über eine Doppelbindung an einen Sauerstoff gebunden ist. Der Elternteil der Klasse der Phosphinsäuren.
Herstellung
Hypophosphorige Säure kann nach verschiedenen Methoden hergestellt werden:
1. Siedender weißer Phosphor mit Calciumhydroxid:
P4 + 4Ca (OH)2 + 8H2O → 4Ca (H2PO2)2 + 4H2
Das Calciumsalz ist in Wasser löslich. Die Behandlung mit Schwefelsäure ergibt diehypophosphorige Säure:
(H2PO2) 2Ca + H2SO4 → 2H3PO2 + CaSO4
Das Produktgemisch wird filtriert, um unlösliches CaSO4 zu entfernen. Die wäßrige Lösung der hypophosphorigen Säure wird unter vermindertem Druck eingeengt.Anstelle von Calciumhydroxid kann konzentriertes Barytwasser verwendet werden.2. Durch Behandlung von Natriumhypophosphit nah2po2mit einem Ionenaustauscherharz.Das Natriumsalz kann durch Kochen von weißem Phosphor mit einer Lösung von Natriumhydroxid hergestellt werden, eine Reaktion ähnlich (1) oben.
PH3 + 2I2 + 2H2O → H3PO2 + 4HI
Das obige Verfahren kann als sicherer angesehen werden als das Erhitzen von Weißphosphor mit einem Alkali.
Hypophosphorige Säure muss unter 50 ° C gelagert werden.
Herstellungsverfahren
Hypophosphorige Säure wird durch Reaktion von Bariumhypophosphit und Schwefelsäure und Abfiltrieren von Bariumsulfat gebildet. Durch Eindampfen der Lösung im Vakuum bei 80 °C und anschließendes Abkühlen auf 0 °C kristallisiert hypophosphorige Säure.
Definition
Ein weißer kristalliner Feststoff. Es ist eine einbasige Säure, die das Anion H2PO2 – in Wasser bildet. Das Natriumsalz und damit die Säure kann durch Erhitzen von gelbem Phosphor mit Natronlauge hergestellt werden. Die freie Säure und ihre Salze sind starke Reduktionsmittel.
Reaktionen
Hypophosphorige Säure ist in allen Anteilen mit Wasser mischbar und eine handelsübliche Stärke beträgt 30% H3PO2. Hypophosphite werden in der Medizin verwendet. Hypophosphorige Säure ist ein starkes Reduktionsmittel, z. B. Mit Kupfersulfat bildet kupferhaltiges Hydrid Cu2H2, brauner Niederschlag, der Wasserstoffgas entwickelt und beim Erwärmen Kupfer hinterlässt; mit Silbernitrat ergibt sich fein verteiltes Silber; mit schwefeliger Säure ergibt sich Schwefel und etwas Schwefelwasserstoff; mit Schwefelsäure ergibt sich schwefelige Säure, die wie oben reagiert; bildet Mangansäure mit Permanganat.
Allgemeine Beschreibung
Farblose ölige Flüssigkeit oder zerfließende Kristalle mit saurem Geruch. Dichte 1,439 g / cm3. Schmelzpunkt 26,5 ° C. Einatmen von Dämpfen reizt oder verbrennt die Atemwege. Flüssigkeit und Dämpfe können Augen und Haut reizen oder verbrennen.
Luft & Wasserreaktionen
Zerfließend. Wasserlöslich.
Reaktivitätsprofil
HYPOPHOSPHORIGE SÄURE zersetzt sich beim Erhitzen in Phosphorsäure und selbstentzündliches Phosphin. Wird durch Schwefelsäure unter Freisetzung von Schwefeldioxid und Schwefel oxidiert. Reagiert explosionsartig mit Quecksilber(II) -oxid . Reagiert heftig mit Quecksilber(II) Nitrat . Neutralisiert Basen in exothermen Reaktionen.
Gefahr
Brand- und Explosionsgefahr bei Kontakt mit Oxidationsmitteln.
Gesundheitsgefahr
GIFTIG; Einatmen, Verschlucken oder Hautkontakt mit Material kann zu schweren Verletzungen oder zum Tod führen. Kontakt mit geschmolzener Substanz kann schwere Verbrennungen an Haut und Augen verursachen. Vermeiden Sie jeglichen Hautkontakt. Auswirkungen von Kontakt oder Einatmen können verzögert sein. Feuer kann reizende, ätzende und/oder giftige Gase erzeugen. Abfluss aus Brandschutz- oder Verdünnungswasser kann ätzend und/oder giftig sein und Verschmutzung verursachen.
Brandgefahr
Nicht brennbar, Stoff selbst brennt nicht, kann sich aber beim Erhitzen zersetzen und korrosive und/oder giftige Dämpfe erzeugen. Einige sind Oxidationsmittel und können brennbare Stoffe (Holz, Papier, Öl, Kleidung usw.) entzünden.). Bei Kontakt mit Metallen kann brennbares Wasserstoffgas entstehen. Behälter können beim Erhitzen explodieren.
Reinigungsmethoden
Phosphorige Säure ist eine häufige Verunreinigung von kommerzieller 50% iger hypophosphoriger Säure. Jenkins und Jones reinigten dieses Material, indem sie etwa 600 ml in einem 1 L-Kolben bei 40 o unter vermindertem Druck (in N 2) auf ein Volumen von etwa 300 ml verdampften. Nach dem Abkühlen wurde die Lösung in einen mit einem Stopfen versehenen Erlenmeyerkolben überführt und zum Einfrieren (ggf. unter Verkratzen der Wand) mehrere Stunden in einem Trockeneis/Aceton-Bad stehen gelassen. Wenn der Kolben dann 12 Stunden bei ca 5o belassen wurde, verflüssigten sich etwa 30-40% davon und wurden erneut filtriert. Dieser Vorgang wurde wiederholt, dann wurde der Feststoff über Mg(ClO4)2 in einem Vakuumexsikkator in der Kälte gelagert. Nachfolgende Kristallisationen aus n-Butanol durch Lösen bei Raumtemperatur und anschließendes Abkühlen im Eissalzbad bei -20 o schienen es nicht weiter zu reinigen. Die freie Säure bildet zerfließende Kristalle m 26,5o und ist in H2O und EtOH löslich. Das NaH2PO2-Salz kann durch ein Anionenaustauscherharz gereinigt werden