Notes basées sur les informations de la « Microbiologie pratique de base » ©Society for General Microbiology.
Se référer aux techniques d’asepsie avant de commencer ce travail ou tout autre travail pratique de microbiologie.
Dans une assiette à verser, une petite quantité d’inoculum d’une culture en bouillon est ajoutée par pipette au centre d’une boîte de Pétri. Le milieu gélosé refroidi, mais toujours fondu, dans un tube à essai ou une bouteille est ensuite versé dans la boîte de Pétri. Le plat est ensuite tourné doucement, ou déplacé d’avant en arrière (d’abord N-S, puis NW-SE, puis NE-SW), pour s’assurer que la culture et le milieu sont bien mélangés et que le milieu recouvre uniformément la plaque.
Les plaques de coulée permettent aux micro-organismes de se développer à la fois à la surface et dans le milieu. La plupart des colonies poussent dans le milieu et sont de petite taille et peuvent être confluentes. Les quelques colonies qui poussent à la surface sont de la même taille et de la même apparence que celles d’une plaque à stries.
Ces plaques pourraient ensuite être utilisées pour tester les effets antimicrobiens de diverses substances. Pour plus d’informations, voir Étude de l’action antimicrobienne.
Sinon, de telles plaques pourraient faire partie de l’étude de la population de bactéries dans un échantillon. La culture de dilutions en série de cette manière permet de calculer la taille de la population d’un échantillon bactérien. Si la dilution et le volume d’inoculum, généralement de 1 cm3, sont connus, le compte viable de l’échantillon par cm3 peut être déterminé. Le nombre viable est le nombre de bactéries ou d’amas de bactéries par cm3. Les dilutions choisies doivent produire entre 30 et 100 colonies dénombrables distinctes. (Voir aussi Technique standard: Faire des dilutions en série)
Santé & Sécurité et Notes techniques
1 Utiliser un bain-marie à 50 °C pour stocker les bouteilles de gélose fondue.
2 Veillez à ne pas contaminer la gélose fondue dans les bouteilles avec de l’eau du bain-marie. Pour éviter toute contamination, assurez-vous :
i que l’eau du bain-marie soit à la bonne profondeur
ii que les bouteilles soient maintenues en position verticale
iii que l’extérieur des bouteilles soit essuyé avant leur utilisation.
3 Dans une plaque de coulée uniformément répartie, la base de la plaque doit être recouverte, la gélose ne doit pas toucher le couvercle de la plaque et la surface doit être lisse sans bulles.
4 Manuel de laboratoire CLEAPSS la section 15.2.12 suggère quelques méthodes alternatives de fabrication d’une plaque de coulée et examine leurs avantages et leurs inconvénients.
Procédure
Inoculation à l’aide d’une pipette Pasteur
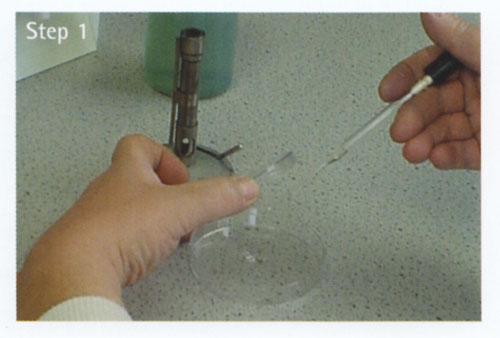
En tout temps, maintenez la pipette aussi immobile que possible.
a Desserrer le bouchon/bouchon de coton du flacon contenant l’inoculum.
b Retirez la pipette Pasteur stérile de son récipient, fixez la tétine et tenez-la dans votre main droite.
c Soulevez la bouteille / le tube à essai contenant l’inoculum avec votre main gauche.
d Retirez le bouchon / bouchon de coton avec le petit doigt de votre main droite.
e Enflammer le goulot de la bouteille/du tube à essai.
f Pressez très légèrement le bulbe de la pipette. Mettez la pipette dans le flacon / tube à essai et établissez le volume requis de la culture. Ne pressez pas le bulbe de la pipette après qu’il soit dans le bouillon car cela pourrait provoquer des bulles et éventuellement des aérosols.
g Retirer la pipette et enflammer à nouveau le goulot de la bouteille/du tube à essai. Remplacez le bouchon / le bouchon en coton.
h Placez la bouteille / le tube à essai sur le banc ou dans son rack.
Inoculer la boîte de Pétri
a Soulevez légèrement le couvercle de la boîte de Pétri avec la main droite et insérez la pipette dans la boîte de Pétri. Relâchez doucement le volume d’inoculum requis au centre du plat. Remplacez le couvercle.
b Mettre la pipette dans un pot à jeter.
Verser la plaque
a Prélever une bouteille de gélose fondue stérile au bain-marie (note 1 et 2).
b Tenez la bouteille dans votre main droite. Retirez le capuchon avec le petit doigt de votre main gauche.
c Enflammer le goulot de la bouteille.
d Soulevez légèrement le couvercle de la boîte de Pétri avec la main gauche et versez la gélose fondue stérile dans la boîte de Pétri. Remplacez le couvercle.
e Enflammer le goulot de la bouteille et replacer le bouchon.


f Déplacez doucement le plat pour bien mélanger la culture et le milieu et pour s’assurer que le milieu recouvre uniformément la plaque (note 3). Déplacez le plat dans trois directions: d’abord N-S, puis NW-SE, puis NE-SW, ou faites-le pivoter jusqu’à ce que le milieu et l’inoculum soient bien mélangés et recouvrent la base du plat.
g Laisser la plaque se solidifier.
h Scotchez la plaque fermée et incubez en position inversée.
Liens Web
Ressources pour enseignants en microbiologie
Society for General Microbiology – source of Basic Practical Microbiology, un excellent manuel de techniques de laboratoire et de microbiologie pratique pour les écoles secondaires, une sélection de pratiques éprouvées utilisant des micro-organismes.
Microbiologie en ligne
MiSAC (Comité consultatif sur la microbiologie dans les écoles) est soutenu par la Society for General Microbiology (voir ci-dessus) et leurs sites Web incluent plus d’informations sur la sécurité et un lien pour demander des conseils par e-mail.
(Sites Web consultés en octobre 2011)