説明
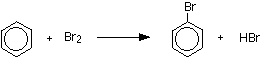
ベンゼン塩素や臭素のようなハロゲン(塩前者)と反応し、これらの反応は塩化アルミニウム、二塩化硫黄、塩化第二鉄または鉄のようなルイス酸の触媒の存在下で求電子置換反応と呼ばれています。 ベンゼンが臭化物を反応させるときに臭化物アルミニウムが使用される。鉄は少量の塩素や臭素と反応して塩化鉄(III)Fecl3や臭素鉄(III)FeBr3を形成するため、触媒ではない。
2fe+3cl2→2fecl3
2fe+3br2→2febr3
塩素との反応
ベンゼン塩化アルミニウムまたは鉄の存在下で塩素と反応してクロロベンゼンを調製する。
C6H6+Cl2→C6H5Cl+HCl
臭素との反応
ベンゼン臭化物アルミニウムまたは鉄の存在下で臭素と反応してブロモベンゼンを生成する。 鉄は容易に入手可能で安価であるために使用されます。
C6H6+Br2→C6H5Br+HBr
付加反応
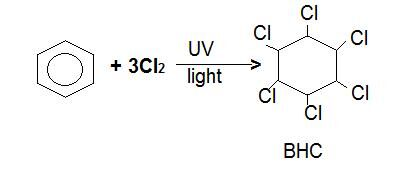
熱ベンゼンの付加反応は、塩素または臭素との紫外線の存在下で受ける。 塩素か臭素原子は炭素原子で加え、ringdelocalizationは永久に壊れています。
例:1,2,3,4,5,6-ヘキサクロロシクロヘキサンは、熱いベンゼンを介して気泡塩素ガスが紫外線に1時間さらされると生成されます。
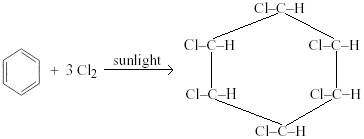
臭素は同様に作用し、塩素と水素は環のランダムな位置に上下に固着することによって異性体の数を作る。 炭素-炭素二重結合は破壊され、回転することができない。 別の異性体は、BCH、HCH、およびGammexaneと呼ばれる殺虫剤として一般的に使用されています。 塩素化炭化水素とも呼ばれ、環境に非常に有害です。.
メチルベンゼンのハロゲン化
置換反応
置換メチルベンゼンと塩素または臭素との反応は二つの方法で起こる:
- 環への置換
- 置換メチル基への置換
環への置換
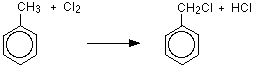
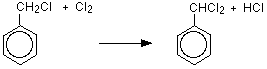
これは室温で塩化アルミニウムまたは鉄の存在下およびUV光の非存在下で行われる。 メチル基は環の2または4位に結合し、新しい基はthemethyl基の隣の環に結合する。 塩素との置換反応は、2-クロロメチルベンゼンと4-クロロメチルベンゼンの二つの生成物を生成する。
C6H5CH3+Cl2→C6H4Ch3Cl+HCl
メチル基への置換
置換UV光の存在下および触媒の非存在下でメチルベンゼンを沸騰させる環ではなく、メチル基中の塩素または臭素の反応。
形成される生成物は(クロロメチル)ベンゼンであり、括弧内に書かれた名前は塩素がメチル基に結合しており、環とは結合していないことを示している。
メチル基の水素原子は塩素原子で置換され、メチル基の3つの水素原子はすべて塩素原子で置換されます。 水素原子が一つずつ置換されているため,新製品は(ジクロロメチル)ベンゼンと(トリクロロメチル)ベンゼンである。
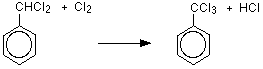
求電子剤の形成
環内の電子の非局在化は塩素-塩素結合を反発させるので、塩素分子はベンゼン環に近づく。
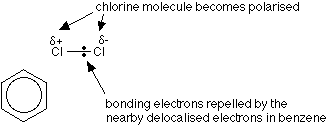
分極のAluminumchlorideの助け、塩素の分子の行為のastheの求電子剤の肯定的な端。
求電子置換機構
第一段階
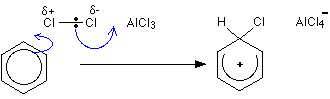
第二段階
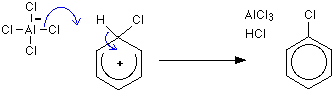
第一段階の水素はAlCl–4イオンを介して除去されるが、第二段階の塩化アルミニウムは再生される。
ベンゼンの塩素化機構
最初のステップ:
クロロニウムイオン形成、塩素はルイス酸と反応して塩素をより求電子性にする複合体を形成する。
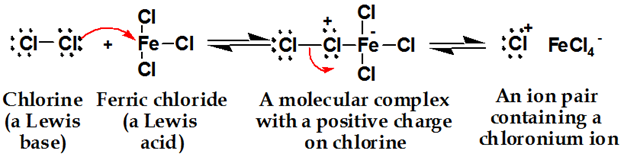
第二段階:
クロロニウムイオンがリングに攻撃。 芳香族C=Cの二重結合電子は求核剤として作用し、求電子Clを攻撃し、非局在化が起こる。
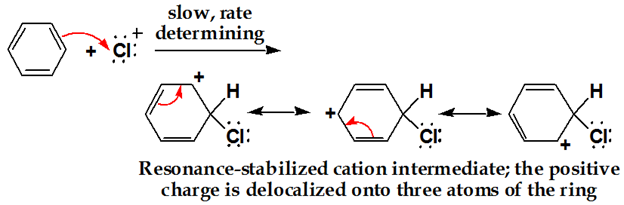
第三段階:
プロトン移動は、環の芳香族特性を再生する。
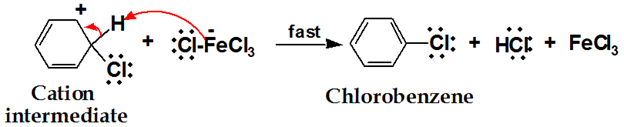
クロロベンゼンは
- を使用しますそれは硫酸の存在下での塩素との反応の助けを借りて農薬DDTの製造に使用されます。
- 除草剤、染料、ゴムなどの商品の調製に中間体として使用されます。
- itisはまた接着剤、ペンキ、ペンキの除去剤、光沢、染料および薬剤の準備のために高沸点の溶媒として使用されます。
- それはまたポリウレタン絶縁材の準備のために使用されます。
健康上の問題
高レベルの経験頭痛、しびれ、眠気、吐き気、嘔吐にさらされた人。 クロロベンゼンはまた、神経系の多くの部分の機能の低下にも影響する。 軽度から重度の曝露の動物では、脳、肝臓および腎臓に影響を与える。 また、先天性欠損症を引き起こす。