Gjør den aromatiske ringen tilgjengelig for angrep av nukleofiler
De fleste preparater av aromatiske forbindelser vi har sett (for eksempel elektrofil aromatisk substitusjon, samt Suzuki-reaksjonen dekket i forrige avsnitt) involverer den aromatiske ringen som nukleofil, som reagerer med et elektrofilt reagens. Nukleofil aromatisk substitusjon (i 17.1.) involverer nukleofile reagenser, men det er begrenset til ringer med sterke elektronuttakende grupper ortho eller para til a forlate gruppen. Den mest allsidige måten å lage aromatiske ringer tilgjengelig for nukleofil angrep er å forberede arenediazoniumsalter, som inneholder ArN2 + ion. Diagrammet nedenfor viser forskjellige reaksjoner som er mulige med arenediazoniumsalter.

Arenediazoniumsalter fremstilles lett fra arylaminer (aniliner) ved hjelp av en prosess som kalles diazotization. Prosessen innebærer oppløsning av amin i en egnet syre, avkjøling i et isbad til 0-5 oC, og deretter tilsetning av natriumnitritt (NaNO2) løsning. Syren reagerer Med NaNO2 for å danne salpetersyre (HNO2), som deretter reagerer med arylamin for å danne arenediazoniumsaltet. Det vanligste saltet som brukes til disse reaksjonene er kloridet (laget Med HCl som syre), som er ganske løselig, men dekomponerer raskt ved romtemperatur. I noen reaksjoner (som fenoldannelse) kan kloridionet forstyrre Og erstatte En Cl, så i de tilfellene brukes sulfatet (laget VED HJELP AV H2SO4). Diazoniumsulfater er litt mer stabile enn klorider, men de er også generelt mindre oppløselige og dermed vanskeligere å bruke. Diazonium tetrafluoroborates er laget av klorider ved å tilsette HBF4; de er vanligvis helt uoppløselige, noe som gjør at de kan filtreres av, deretter tørkes for dekomponering uten vann til stede for å introdusere et fluor på ringen. Denne metoden for å introdusere fluor på en aromatisk ring kalles Balz-Schiemann-reaksjonen.
Arenediazoniumsalter er nyttige mellomprodukter,og de mister lett nitrogenreaksjon med en rekke nukleofiler, som vist i diagrammet ovenfor. Siden nitrogen er veldig stabilt, og går tapt som en gass, gir dette en kraftig drivkraft for at disse reaksjonene skal oppstå. I tilfelle av vann eller jodidion reagerer nukleofilen uten behov for katalyse. Imidlertid katalyseres mange reaksjoner av diazoniumsalter av kobber (I), i hvilket tilfelle reaksjonen refereres til Som En Sandmeyer-reaksjon.
en reaksjon som beholder de to nitrogenene innebærer kobling til en annen (elektronrik) aromatisk ring, som vist på venstre del av reaksjonsskjemaet. Dette er svært viktig i kunstig fargestoffindustrien, som hovedsakelig ble etablert ved å bruke produksjonen av disse «azofargestoffene» etter oppdagelsen Av Perkins mauve i 1856.
bruk i syntese
diazoniumsaltkjemi, basert på nukleofile reagenser brukt med en elektrofil aromatisk ring, er komplementær til elektrofil aromatisk substitusjon (EAS, som bruker elektrofile reagenser). Diazoniumsalter fremstilles lett fra aromater via en tretrinns syntese:

hvis andre substituenter er nødvendig, kan disse innføres under syntesen. Hvis en metasubstituent er nødvendig, blir substituenten introdusert på eller før nitro-scenen; for ortho / para-substituenter kan dette gjøres PÅ NH2-scenen. Aminogruppen i en arylamin (anilin) er en meget kraftig aktivator, så mange eas-reaksjoner av arylaminer innfører raskt 2 eller 3 substituenter, med mindre NH2-gruppens reaktivitet modereres ved dannelse av et amid – tilbakekall denne metoden for beskyttelse av aminer via acetylering, fra kapittel 16. I noen tilfeller kan den nye substituenten også reduseres under reduksjonen av nitrogruppen, som i denne syntesen av meta-propylbenzenediazoniumklorid fra benzen:
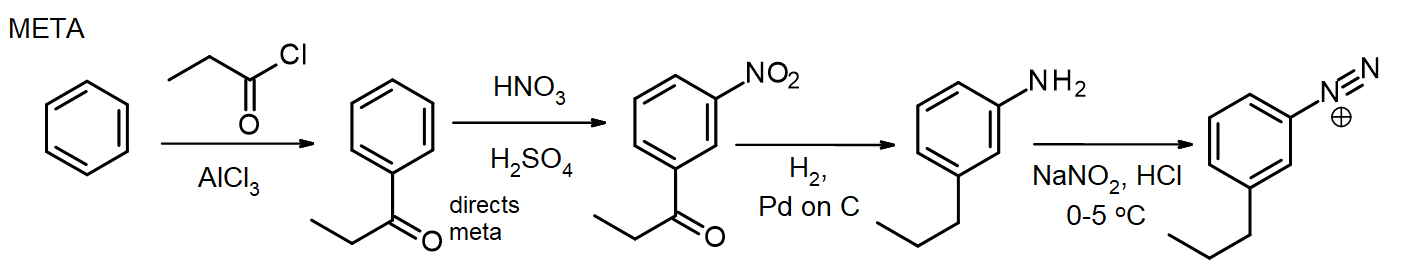
for syntesen av paraisomeren acetyleres arylaminet før Friedel-Crafts-reaksjonen, deretter deacetyleres ved oppvarming med overskudd av aq. HCl rett før diazotization.

denne para-isomersyntesen viser bruken av acetylgruppen for å kontrollere reaktiviteten til aminogruppen. (En alternativ syntese kan unngå dette ved å introdusere propylgruppen først, før nitrering. Selv om disse syntesene ser ut til å være lange, involverer de syntetiske trinn som er pålitelige og reproduserbare, og de følger et standardmønster. Også det faktum at forskjellige substituenter kan innføres på utvalgte stillinger underveis, gjør denne tilnærmingen til en svært verdifull syntetisk sekvens.