Finegoldia magna es un coco grampositivo estrictamente anaeróbico que forma parte de la flora comensal de la piel, la cavidad oral, el tracto gastrointestinal y el tracto urogenital femenino.1,2 Describimos un caso inusual de absceso glúteo complicado causado exclusivamente por un patógeno oportunista en un paciente con diabetes mellitus que no había recibido inyecciones intramusculares previas en la zona afectada.
Un hombre de 60 años de edad acudió al servicio de urgencias con dolor intenso y supuración en la nalga izquierda que había comenzado 2 semanas antes. Los antecedentes del paciente incluyen hipertensión, dislipidemia, sobrepeso (índice de masa corporal, 29), vitíligo, tabaquismo activo (20 cigarrillos al día) y diabetes mellitus tipo 2 de 12 años de duración con buen control glucémico sin evidencia de complicaciones metadiabéticas (HbA1, 7%), aunque en las últimas semanas informó de empeoramiento del control glucémico en el hogar, coincidiendo con el proceso infeccioso. El paciente no informó de inyecciones intramusculares glúteas previas. Estaba en tratamiento con ácido acetilsalicílico (100 mg/24 h), atorvastatina (10 mg/24 h), glimepirida (2 mg/24 h), y bisoprolol (5 mg/24 h).
El examen físico reveló una hinchazón grande, dolorosa, caliente y fluctuante en la nalga izquierda acompañada de crepitación y supuración activa, y un área necrótica de 10 cm (Fig. 1). Las pruebas de laboratorio revelaron lo siguiente: hemoglobina, 15 g / dL; leucocitos, 10 870 mm3; plaquetas, 121 000 mm3; tiempo de protrombina, 16%; glucosa, 370 mg / dL; urea, 67 mg / dL; creatinina, 1,25 mg / dL; ácido láctico 2 mmol / L; procalcitonina, 1,19 ng / ml; proteína C reactiva, 249 mg / L.
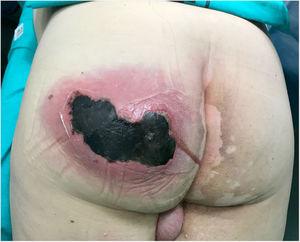
Absceso en la nalga izquierda con supuración activa y un área grande (10 cm) de necrosis.
Con base en los hallazgos clínicos, el paciente fue sometido a drenaje de emergencia en el quirófano. Se extrajo un litro de pus, se tomaron muestras para cultivo y se realizó una escisión amplia del tejido necrótico. Durante el postoperatorio, el paciente mostró un curso clínico favorable, recuperando el control glucémico y la movilidad y funcionalidad de la pierna izquierda.
Los cultivos de abscesos fueron negativos para bacterias aeróbicas y positivos solo para cocos grampositivos estrictamente anaeróbicos, cuyo tipo bacteriano se identificó como F magna. Un antibiograma para F magna reveló sensibilidad a amoxicilina-ácido clavulánico, metronidazol y clindamicina, y no evidencia de resistencia a los antibióticos. El paciente fue dado de alta hospitalaria y se le prescribió tratamiento antibiótico (metronidazol, 500 mg/8 h) y atención ambulatoria de heridas quirúrgicas, a lo que respondió bien.
F magna, anteriormente conocido como Peptostreptococcus magnus, ha sufrido múltiples cambios taxonómicos desde que fue descrito por primera vez en 1933 por Prevot, quien usó el término Diplococcus magnus.3
F magna es probablemente el más común de todos los cocos anaeróbicos grampositivos (GPAC) y la forma más patógena encontrada en muestras clínicas humanas. Este microorganismo es parte de la biota normal y se encuentra predominantemente en la piel, el tracto gastrointestinal, el tracto genitourinario femenino y, en menor medida, la cavidad oral.1,2 En los últimos años, se han identificado 2 proteínas importantes que explican la capacidad de virulencia y colonización de F magna: la proteína de adhesión superficial FAF (factor de adhesión F magna) y la serina proteasa SufA, similar a la subtilisina.2,4 En las capas superiores de la epidermis, el FAF media la adhesión mediante la unión a galectina-7, un marcador de células de queratinocitos. Después de que las bacterias se mueven más profundamente en la piel y alcanzan la membrana basal, el SufA descompone el colágeno IV. En la dermis, el FAF interactúa con el colágeno V y la fibrilina, lo que supuestamente explica cómo el F magna puede alcanzar las capas más profundas del tejido dérmico durante la infección.5
F magna es una de las especies cultivadas más comúnmente de abscesos de la piel, tejidos blandos, huesos y articulaciones, generalmente en cultivos polimicrobiales, y en casos raros en cultivos puros.3 Mediastinitis postoperatoria, endocarditis protésica valvular y neumonía necrotizante por F magna han sido descritas.6 El uso de antibióticos de amplio espectro que alteran la microbiota de la piel, la introducción de materiales extraños (válvulas protésicas, articulaciones de reemplazo, catéteres) y el aumento del número de pacientes tratados con fármacos inmunosupresores favorecen estas infecciones al crear un entorno óptimo para estos patógenos oportunistas.
La resistencia a los antimicrobianos entre las bacterias anaeróbicas está aumentando en todo el mundo.7 La mayoría de los GPAC (>90%) son susceptibles a la penicilina, y muchos también son susceptibles a otros antibióticos β-lactámicos,7-10 pero muestran una resistencia creciente a otros antibióticos como la clindamicina, el metronidazol y las fluoroquinolonas.8-10 Las tasas de resistencia a la clindamicina entre los GPACS varían de 7% a 20%, pero están aumentando en ciertas especies, incluidas las especies F magna y Peptoniphilus.7 La mayoría de los GPAC todavía son susceptibles al metronidazol, aunque se han descrito algunas cepas resistentes al metronidazol de F magna y Parvimonas micra.9
El presente caso ilustra cómo la bacteria comensal F magna es capaz de producir una infección necrosante avanzada, y subraya la importancia de la identificación a nivel de especie y la determinación de la sensibilidad antimicrobiana de bacterias anaeróbicas a partir de muestras representativas cuando se aísla en cultivos puros.
Conflictos de intereses
Los autores declaran no tener conflictos de intereses.