at gøre den aromatiske ring tilgængelig for angreb fra nukleofiler
de fleste præparater af aromatiske forbindelser, vi har set (såsom elektrofil aromatisk substitution, såvel som Susuki-reaktionen dækket i det foregående afsnit) involverer den aromatiske ring som nukleofil, der reagerer med et elektrofilt reagens. Nukleofil aromatisk substitution (i 17.1.) involverer nukleofile reagenser, men det er begrænset til ringe med stærke elektronudtagende grupper ortho eller para til en forlader gruppe. Den mest alsidige måde at gøre aromatiske ringe til rådighed for nukleofilt angreb er at forberede arenediasoniumsalte, der indeholder ArN2 + ion. Diagrammet nedenfor viser de forskellige reaktioner, der er mulige med arendiasoniumsalte.

Arylaminer (aniliner) fremstilles let ved hjælp af en proces kaldet diasotisering. Processen involverer opløsning af aminen i en egnet syre, afkøling i et isbad til 0-5 oC og derefter tilsætning af natriumnitrit (NaNO2) opløsning. Syren reagerer med NaNO2 for at danne salpetersyre (HNO2), som derefter reagerer med arylaminen for at danne arenediasoniumsaltet. Det mest almindelige salt at bruge til disse reaktioner er chlorid (fremstillet ved hjælp af HCI som syre), som er ret opløselige, men nedbrydes hurtigt ved stuetemperatur. I nogle reaktioner (såsom phenoldannelse) kan chloridionen imidlertid interferere og erstatte en Cl, så i disse tilfælde anvendes sulfatet (fremstillet ved anvendelse af H2SO4). Sulfater er lidt mere stabile end chlorider, men de er også generelt mindre opløselige og dermed mere akavede at bruge. Tetrafluorborater fremstilles af chlorider ved tilsætning af HBF4; de er normalt fuldstændigt uopløselige, hvilket gør det muligt at filtrere dem af og derefter tørres til nedbrydning uden vand til stede for at indføre en fluor på ringen. Denne metode til indføring af fluor på en aromatisk ring kaldes Bals-Schiemann-reaktionen.
Arenediasoniumsalte er nyttige mellemprodukter, og de taber let nitrogen reagerer med en række nukleofiler, som vist i diagrammet ovenfor. Da kvælstof er meget stabilt og går tabt som en gas, giver dette en kraftig drivkraft for, at disse reaktioner kan forekomme. I tilfælde af vand eller iodidion reagerer nukleofilen uden behov for nogen katalyse. Imidlertid katalyseres mange reaktioner af kobber(I), i hvilket tilfælde reaktionen betegnes som en Sandmeyer-reaktion.
en reaktion, der bevarer de to nitrogener, involverer kobling til en anden (elektronrig) aromatisk ring, som vist på den venstre del af reaktionsplanen. Dette er meget vigtigt i den kunstige farvestofindustri, der hovedsageligt blev etableret ved hjælp af produktionen af disse “asofarvestoffer” efter opdagelsen af Perkins mauve i 1856.
anvendelse i syntese
diasoniumsaltkemi, der er baseret på nukleofile reagenser anvendt med en elektrofil aromatisk ring, er komplementær til elektrofil aromatisk substitution (EAS, der bruger elektrofile reagenser). Salte fremstilles let fra aromater via en tre-trins syntese:

hvis der er behov for andre substituenter, kan disse introduceres under syntesen. Hvis der er behov for en metasubstituent, introduceres substituenten på eller før nitrostadiet; for ortho / para-substituenter kan dette gøres på NH2-stadiet. Aminogruppen i en arylamin (anilin) er en meget kraftig aktivator, så mange EAS – reaktioner af arylaminer introducerer hurtigt 2 eller 3 substituenter, medmindre NH2-gruppens reaktivitet modereres ved dannelse af et amid-husk denne metode til beskyttelse af aminer via acetylering fra kapitel 16. I nogle tilfælde kan den nye substituent også reduceres under reduktionen af nitrogruppen, som i denne syntese af meta-propylbensenediasoniumchlorid:
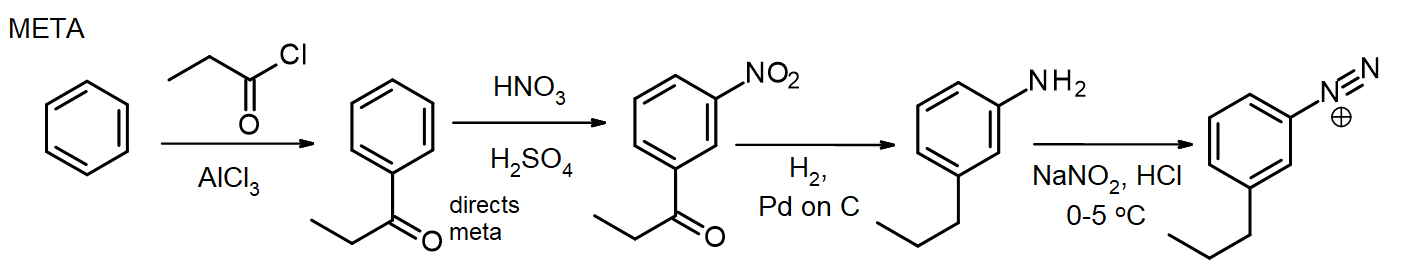
til syntesen af para-isomeren acetyleres arylaminen før Friedel-Crafts-reaktionen, derefter deacetyleres ved opvarmning med overskydende AKV. HCI lige før diasotisering.

denne para-isomersyntese viser brugen af acetylgruppen til at kontrollere aminogruppens reaktivitet. (En alternativ syntese kunne undgå dette ved først at introducere propylgruppen før nitrering.) Selvom disse synteser ser ud til at være lange, involverer de syntetiske trin, der er pålidelige og reproducerbare, og de følger et standardmønster. Det faktum, at forskellige substituenter kan introduceres på udvalgte positioner undervejs, gør denne tilgang til en meget værdifuld syntetisk sekvens.