- Galería de Imágenes Digitales de Fluorescencia
- Células Epiteliales Renales Caninas Madin-Darby (Línea MDCK)
- Imágenes Adicionales de Fluorescencia de Células de Riñón Canino Madin-Darby (MDCK)
- ¿Preguntas o comentarios? Envíenos un correo electrónico.
- © 1998-2021 por Michael W. Davidson y la Universidad Estatal de Florida. Todos los Derechos Reservados. No se pueden reproducir ni utilizar de ninguna manera imágenes, gráficos, scripts o applets sin el permiso de los titulares de los derechos de autor. El uso de este sitio web significa que acepta todos los Términos y Condiciones Legales establecidos por los propietarios.
- Este sitio web es mantenido por nuestro Graphics &Equipo de Programación web en colaboración con Optical Microscopy en el National High Magnetic Field Laboratory.
- Última modificación: Viernes, 13 de noviembre de 2015 a las 02: 19 PM
- Cuenta de acceso Desde julio 16, 2004: 79076
- Microscopios, filtros de fluorescencia y equipos de imágenes digitales proporcionados por:
Galería de Imágenes Digitales de Fluorescencia
Células Epiteliales Renales Caninas Madin-Darby (Línea MDCK)
Derivada por S. H. Madin y N. B. Darby del tejido renal de una hembra adulta cocker spaniel, la línea celular MDCK se originó en septiembre de 1958. Desde entonces, las células se han utilizado ampliamente para investigar el procesamiento de la proteína precursora beta-amiloide, así como la clasificación de sus productos proteolíticos.
La morfología de la línea celular MDCK es epitelial, y las células son positivas para queratina por tinción de inmunoperoxidasa. Los virus a los que las células MDCK son susceptibles incluyen estomatitis vesicular (cepa de Indiana), vaccinia, virus coxsackievirus B5, reovirus 2 y 3, adenovirus 4 y 5, exantema vesicular de cerdos y hepatitis canina infecciosa. Las células exhiben resistencia al virus coxsackievirus B3 y B4, así como al poliovirus 2, y son negativas para la transcriptasa inversa.
La línea MDCK se usa comúnmente como modelo general para células epiteliales, que comprenden el tipo de tejido conocido como epitelio. El epitelio, que se encuentra principalmente cubriendo los órganos internos y otras superficies del cuerpo, está compuesto de células apretadas que se organizan en láminas. Estas células secretan una matriz extracelular llamada lámina basal en su base, que ayuda a anclar el tejido epitelial a los tejidos adyacentes. Las células epiteliales también carecen de acceso directo a los vasos sanguíneos y, por lo tanto, deben obtener oxígeno y nutrientes a través de la difusión, de la misma manera que se ven obligadas a deshacerse de los productos de desecho metabólicos. Los epitelios funcionan en una variedad de mecanismos, incluyendo protección, absorción, recepción sensorial y secreción. Las células epiteliales de los riñones desempeñan un papel clave en el almacenamiento temporal y la posterior secreción de materiales excretores.
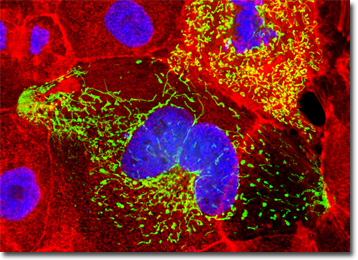
El cultivo de células renales caninas Madin-Darby presentado en la imagen digital de arriba se etiquetó con DAPI y Alexa Fluor 568 conjugados con faloidina, que se dirigen al ADN en el núcleo celular y a la red citoesquelética de actina F, respectivamente. Además, las células se transfectaron con un vector de localización subcelular plásmido quimérico pEYFP-Mitocondrias (proteína fluorescente amarilla mejorada). Las imágenes se grabaron en escala de grises con un sistema de cámara Qimaging Retiga Fast-EXi acoplado a un microscopio Olympus BX-51 equipado con bloques ópticos de filtro de fluorescencia de emisión de paso de banda proporcionados por Omega Optical. Durante la etapa de procesamiento, los canales de imagen individuales se pseudocolorizaron con valores RGB correspondientes a cada uno de los perfiles espectrales de emisión de fluoróforos.
Imágenes Adicionales de Fluorescencia de Células de Riñón Canino Madin-Darby (MDCK)
Células epiteliales MDCK con CMXRos rojos MitoTracker, Alexa Fluor 488 y DAPI-Un cultivo adherente de células renales caninas Madin-Darby se etiquetó para la red mitocondrial intracelular y para actina filamentosa con CMXRos Rojos MitoTracker y Alexa Fluor 488 conjugados con faloidina, respectivamente. La sonda absorbente de rayos ultravioleta DAPI se utilizó para contra-teñir el ADN.
![]()
Dirigido a Peroxisomas y Proteínas de Clatrina en Células Renales Madin-Darby con Inmunofluorescencia : En esta sección, el cultivo destacado de células MDCK se etiquetó inmunofluorescentemente con anticuerpos monoclonales primarios de ratón anti-clatrina (cadena pesada) seguidos de fragmentos Fab anti-ratón de cabra conjugados con el tinte de cianina Cy3 para dirigirse a la red citoesquelética. Además, los peroxisomas presentes en el cultivo fueron etiquetados inmunofluorescentemente con anticuerpos secundarios conjugados con Cy2 de cabra dirigidos contra anticuerpos primarios anti-PMP 70 (proteína de membrana peroxisomal 70) de conejo. Los núcleos fueron contra-teñidos con Hoechst 33342.
![]()
Localización Subcelular Mejorada de Proteínas Amarillas de Mitocondrias en Cultivos de Células MDCK – Un cultivo de células epiteliales renales caninas Madin-Darby se transfectó con un vector de localización subcelular plásmido quimérico de Mitocondrias pEYFP (proteína fluorescente amarilla mejorada). Las células también fueron teñidas con SYTOX Orange y Alexa Fluor 350 conjugadas con faloidina, dirigidas al ADN y a la red de actina filamentosa citoesquelética, respectivamente.
![]()
Inmunofluorescencia Dirigida a las Histonas y al Complejo Golgi en Cultivos de Células Epiteliales Renales Caninas: Las células renales caninas Madin-Darby se fijaron con paraformaldehído, se permeabilizaron y se trataron con una mezcla de anticuerpos primarios de conejo (antigiantin) y ratón (antihistonas; pan), seguidos de anticuerpos secundarios conjugados con Alexa Fluor 488 y Texas Red, respectivamente. El cóctel de anticuerpos secundarios también contenía Alexa Fluor 350 conjugado con faloidina, diseñado para atacar simultáneamente la red filamentosa de actina.
![]()
Inmunofluorescencia Doble de Proteínas del Complejo de Poros Nucleares y Uniones Estrechas en Células Renales Caninas Madin-Darby: Se obtuvieron imágenes simultáneas de uniones estrechas de células epiteliales y proteínas del complejo de poros nucleares en células MDCK con un cóctel de anticuerpos primarios anti-NPCP de ratón y anti-ZO-3 de conejo, seguidos de anticuerpos secundarios anti-ratón de cabra y anti-conejo conjugados con Alexa Fluor 488 y Alexa Fluor 568, respectivamente.
![]()
La Red Mitocondrial en Células MDCK-Un cultivo monocapa adherente de células renales caninas Madin-Darby se etiquetó inmunofluorescentemente con anticuerpos proteicos inhibidores del complejo V de oxfos primarios de ratón, seguidos de fragmentos Fab anti ratón de cabra conjugados con fluoresceína. El cultivo fue posteriormente teñido con Alexa Fluor 568 conjugado con faloidina para revelar detalles de la red de actinas filamentosas, y DAPI para ADN en el núcleo.
![]()
Las células MDCK con lectinas de Aglutinina de Germen de trigo son una clase especializada de proteínas vegetales que se unen a grupos específicos de carbohidratos unidos a proteínas o que residen en membranas celulares. Un miembro prominente de este grupo, la aglutinina de germen de trigo se usa a menudo para localizar el complejo Golgi en experimentos de etiquetado de fluorescencia. El cultivo ilustrado en esta sección fue etiquetado con aglutinina de germen de trigo conjugada con Rojo de Texas, así como Alexa Fluor 488 conjugado con faloidina y DAPI (ADN dirigido al núcleo).
![]()
Focalización de las Mitocondrias con Proteínas Fluorescentes en Cultivos de Células Renales Caninas – Un cultivo semi-confluente de células MDCK se transfectó transitoriamente con una quimera plásmida que contenía la secuencia de codificación de la proteína fluorescente amarilla mejorada (EYFP) fusionada a la secuencia de orientación mitocondrial de la subunidad VIII de la citocromo C oxidasa humana. Después de la fijación y permeabilización, las células fueron contra-teñidas para actina filamentosa con Alexa Fluor 546 conjugado con faloidina y para ADN con el tinte nuclear específico, DAPI.
![]()
Uniones estrechas en Cultivos de Células Renales Caninas Madin-Darby: La proteína de unión estrecha ZO – 3 se visualizó por inmunofluorescencia en un cultivo confluente de células MDCK. Los anticuerpos anti-ZO-3 de conejo dirigidos a la proteína se marcaron con fragmentos secundarios de Fab de cabra y conejo conjugados con el tinte de cianina, Cy3. Los núcleos fueron contrarrestados con el fluoróforo DAPI específico del ADN.
![]()
Cultivos de células adherentes a MDCK con Texas Red, Alexa Fluor 488 y Alexa Fluor 350 – En un experimento de etiquetado de inmunofluorescencia doble, se trató un cultivo de células MDCK con un cóctel de anticuerpos primarios antihistonas de ratón (pan) y anti PMP 70 de conejo (proteína de membrana peroxisomal). Las proteínas diana se visualizaron posteriormente con anticuerpos secundarios anti-ratón de cabra y anti-conejo conjugados con Texas Red y Alexa Fluor 488, respectivamente. La red citoesquelética de actina filamentosa se contraestinó con Alexa Fluor 350 conjugado con faloidina.
![]()
Patrones de Tinción Clásicos en Células Epiteliales Renales Caninas: La combinación ahora tradicional y popular de CMXRos rojos MitoTracker, Alexa Fluor 488 conjugado con faloidina y Hoechst 33342 se utilizó para etiquetar tres veces un cultivo adherente de células MDCK. Nótese la inusual red de actinas filamentosas y el gran número de mitocondrias que rodean los núcleos de estas células.
![]()
Localización Subcelular de Mitocondrias con Proteínas Fluorescentes en Células MDCK-Después de la fijación y permeabilización, el cultivo de células MDCK presentado en esta sección fue etiquetado con yoduro de propidio y Alexa Fluor 350 conjugados con faloidina, que se dirigen al ADN y a la actina filamentosa, respectivamente. Además, las células se transfectaron primero con un vector de localización subcelular plásmido de pEYFP-Mitocondrias, localizando así una etiqueta de proteína fluorescente amarilla a la red mitocondrial intracelular.
![]()
La Extensa Red de Tubulina en Células Epiteliales Renales Caninas Madin-Darby – Microtúbulos se tiñeron mediante inmunofluorescencia mediante el tratamiento de un cultivo fijo y permeabilizado de células MDCK con anticuerpos primarios de ratón-anti-alfa-tubulina seguidos de anticuerpos anti-ratón de cabra conjugados con Alexa Fluor 568. Los núcleos estaban contra-teñidos con SYTOX Green. Aunque no se tomaron imágenes en esta sección, el cultivo también se etiquetó con Alexa Fluor 350 conjugado con faloidina.
![]()
Visualización simultánea de Clatrina, Peroxisomas y Núcleos en Cultivos Celulares de MDCK: El cultivo de células de MDCK presentado en esta sección se etiquetó inmunofluorescentemente con anticuerpos monoclonales primarios anti – clatrina (cadena pesada) de ratón seguidos de fragmentos de Fab anti-ratón de cabra conjugados con el tinte de cianina Cy3 para dirigirse a la red citoesquelética. Además, los peroxisomas presentes en el cultivo fueron etiquetados inmunofluorescentemente con anticuerpos secundarios conjugados con Cy2 de cabra dirigidos contra anticuerpos primarios anti-PMP 70 (proteína de membrana peroxisomal 70) de conejo. Los núcleos fueron contra-teñidos con Hoechst 33342.
![]()
La Red de Filamentos Intermedios de Citoqueratina en Células Epiteliales Renales Caninas-La citoqueratina es un componente común y abundante de la red de filamentos intermedios en células epiteliales. El cultivo adherente en esta sección fue etiquetado inmunofluorescentemente con anticuerpos primarios anticitoqueratina de ratón (pan), seguido de anticuerpos secundarios anti ratón de cabra conjugados con Marina Blue. Las mitocondrias se visualizaron con CMXRos de color rojo MitoTracker y los núcleos se teñieron con Verde SYTOX.
![]()
Células Renales Caninas Madin-Darby con Alexa Fluor 488, Alexa Fluor 568 y Hoechst 33258-La localización simultánea de uniones estrechas y proteínas del complejo de poros nucleares (NPCP) se realizó con un experimento de inmunofluorescencia doble con células MDCK utilizando anticuerpos primarios anti-NPCP de ratón y anti-ZO-3 de conejo. Las dianas subcelulares se visualizaron utilizando anticuerpos secundarios (IgG) anti ratón de cabra y anti conejo conjugados con Alexa Fluor 488 y Alexa Fluor 568, respectivamente. El ADN en los núcleos fue contra-teñido usando Hoechst 33258.
![]()
Etiquetado inmunofluorescente de la Red Mitocondrial en Cultivos de células MDCK: Las células renales caninas Madin-Darby se marcaron inmunofluorescentemente con anticuerpos proteicos inhibidores del complejo V de oxfos primarios de ratón, seguidos de fragmentos Fab anti ratón de cabra conjugados con fluoresceína. El cultivo fue posteriormente teñido con Alexa Fluor 568 conjugado con faloidina para revelar detalles de la red de actinas filamentosas, y DAPI para ADN en el núcleo.
![]()
MitoTracker Red CMXRos, Cy2 y Hoechst 33258 en Células Renales Caninas Madin-Darby-Un cultivo adherente fijo y permeabilizado de células renales caninas Madin-Darby fue inmunofluorescentemente marcado con anticuerpos primarios anticitoqueratina de ratón, seguido de fragmentos Fab anti ratón de cabra conjugados con el colorante cianina, Cy2. Antes de la fijación, el cultivo fue tratado durante una hora con MitoTracker CMXRos Rojo, y después de los tratamientos con anticuerpos, los núcleos fueron contra-teñidos con Hoechst 33258.
![]()
Unión de Lectinas al Complejo de Golgi en Cultivos de Células Epiteliales de MDCK: Para visualizar la unión de lectina al complejo de Golgi en células de MDCK, se trató un cultivo adherente con aglutinina de germen de trigo conjugada con Oregon Green. Las células fueron posteriormente contra-teñidas con Alexa Fluor 568 conjugado con faloidina para localizar la red de actina filamentosa, y la tinción de ácido nucleico DAPI para etiquetar el ADN en el núcleo.
![]()
Se emplearon células MDCK adherentes con colorantes Alexa Fluor 488, Alexa Fluor 568 y Hoechst 33342 – Alexa Fluor para visualizar la distribución de clatrina y la proteína de membrana peroxisomal 70 (PMP 70) en un cultivo de células epiteliales renales caninas Madin-Darby. Después de las reacciones de inmunofluorescencia, las células fueron contra-teñidas con Hoechst 33342 para revelar la ubicación de los núcleos.
![]()
Células Renales Caninas Madin-Darby con CMXRos rojos MitoTracker, Alexa Fluor 488 y DAPI – Una de las combinaciones de fluoróforos más útiles para visualizar detalles celulares internos incluye CMXRos rojos MitoTracker para apuntar a las mitocondrias, Alexa Fluor 488 conjugado a faloidina para la red de actinas filamentosas, y DAPI para localizar los núcleos.
![]()
Visualización de las Redes Citoesqueléticas de Microtúbulos y Actina en Cultivos Celulares de MDCK – Para visualizar simultáneamente las redes de actina y tubulina en células de MDCK, se trató un cultivo fijo y permeabilizado con anticuerpos primarios anti-alfa-tubulina de ratón, seguido de un cóctel de anticuerpos secundarios anti-ratón de cabra conjugados con Alexa Fluor 568 mezclados con Alexa Fluor 350 conjugados con faloidina. Los núcleos estaban contra-teñidos con SYTOX Green.
![]()
Inmunofluorescencia Doble de Proteínas del Complejo de Poros Nucleares y Uniones Estrechas en Células Renales Caninas Madin-Darby: Se obtuvieron imágenes simultáneas de uniones estrechas de células epiteliales y proteínas del complejo de poros nucleares en células MDCK con un cóctel de anticuerpos primarios anti-NPCP de ratón y anti-ZO-3 de conejo, seguidos de anticuerpos secundarios anti-ratón de cabra y anti-conejo conjugados con Alexa Fluor 568 y Alexa Fluor 488, respectivamente. Los núcleos fueron contra-teñidos con Hoechst 33258.
![]()
Proximidad del Núcleo y el Complejo de Golgi en Cultivos de Células MDCK Monocapa: La proximidad entre el complejo de Golgi y los núcleos en células renales caninas Madin-Darby se probó en un experimento de inmunofluorescencia doble con anticuerpos primarios anti-NPCP (proteína del complejo de poros nucleares) de ratón y anti-giantin de conejo (complejo de Golgi). Los objetivos de anticuerpos se visualizaron con anticuerpos secundarios de cabra conjugados con Alexa Fluor 568 y Alexa Fluor 488, respectivamente, mientras que el marco citoesquelético de actina se etiquetó con Alexa Fluor 350 conjugado con faloidina.
VOLVER A LA GALERÍA DE FLUORESCENCIA DE CÉLULAS CULTIVADAS
VOLVER A LA GALERÍA DE FLUORESCENCIA
¿Preguntas o comentarios? Envíenos un correo electrónico.
© 1998-2021 por Michael W. Davidson y la Universidad Estatal de Florida. Todos los Derechos Reservados. No se pueden reproducir ni utilizar de ninguna manera imágenes, gráficos, scripts o applets sin el permiso de los titulares de los derechos de autor. El uso de este sitio web significa que acepta todos los Términos y Condiciones Legales establecidos por los propietarios.
Este sitio web es mantenido por nuestro
Graphics &Equipo de Programación web
en colaboración con Optical Microscopy en el
National High Magnetic Field Laboratory.
Última modificación: Viernes, 13 de noviembre de 2015 a las 02: 19 PM
Cuenta de acceso Desde julio 16, 2004: 79076
Microscopios, filtros de fluorescencia y equipos de imágenes digitales proporcionados por:
![]()
![]()
![]()