Finegoldia magna è un coccus gram-positivo strettamente anaerobico che fa parte della flora commensale della pelle, della cavità orale, del tratto gastrointestinale e del tratto urogenitale femminile.1,2 Descriviamo un caso insolito di un complicato ascesso gluteo causato esclusivamente da un patogeno opportunistico in un paziente con diabete mellito che non aveva ricevuto precedenti iniezioni intramuscolari nella zona interessata.
Un uomo di 60 anni è venuto al pronto soccorso con dolore intenso e suppurazione nel gluteo sinistro che era iniziato 2 settimane prima. Il paziente della storia del passato inclusa l’ipertensione, dislipidemia, sovrappeso (indice di massa corporea, 29), la vitiligine, fumo attivo (20 sigarette al giorno), e il diabete mellito di tipo 2 di 12 anni di durata con un buon controllo glicemico senza evidenza di metadiabetic complicazioni (HbA1, 7%), anche se ha riportato un peggioramento del controllo glicemico a casa, nelle ultime settimane, in coincidenza con il processo infettivo. Il paziente non ha riportato precedenti iniezioni intramuscolari glutee. Era in trattamento con acido acetilsalicilico (100 mg/24 h), atorvastatina (10 mg/24 h), glimepiride (2 mg/24 h) e bisoprololo (5 mg/24 h).
L’esame fisico ha rivelato un grande gonfiore fluttuante doloroso e caldo sul gluteo sinistro accompagnato da crepitio e suppurazione attiva e un’area necrotica di 10 cm (Fig. 1). I test di laboratorio hanno rivelato quanto segue: emoglobina, 15 g / dL; leucociti; 10 870 mm3; piastrine, 121 000 mm3; tempo di protrombina, 16%; glucosio, 370 mg / dL; urea, 67 mg / dL; creatinina, 1,25 mg / dL; acido lattico 2 mmol / L; procalcitonina, 1,19 ng / mL; proteina C-reattiva, 249 mg/L.
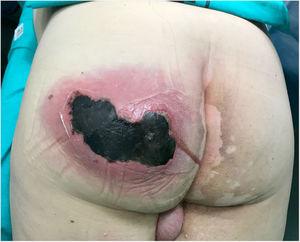
Ascesso sul gluteo sinistro con suppurazione attiva e un’ampia area di necrosi (10 cm).
Sulla base dei risultati clinici il paziente è stato sottoposto a drenaggio di emergenza in sala operatoria. È stato estratto un litro di pus, sono stati prelevati campioni per la coltura e è stata eseguita un’ampia escissione del tessuto necrotico. Durante il periodo postoperatorio il paziente ha mostrato un decorso clinico favorevole, recuperando il controllo glicemico e la mobilità e la funzionalità della gamba sinistra.
Le colture di ascessi erano negative per i batteri aerobici e positive solo per i cocchi gram-positivi strettamente anaerobici, che la tipizzazione batterica identificava come F magna. Un antibiogramma per F magna ha rivelato sensibilità all’acido amoxicillina-clavulanico, al metronidazolo e alla clindamicina e nessuna prova di resistenza agli antibiotici. Il paziente è stato dimesso dall’ospedale e ha prescritto un trattamento antibiotico (metronidazolo, 500 mg/8 h) e la cura delle ferite chirurgiche ambulatoriali, a cui ha risposto bene.
F magna, precedentemente noto come Peptostreptococcus magnus, ha subito molteplici cambiamenti tassonomici da quando è stato descritto per la prima volta nel 1933 da Prevot, che ha usato il termine Diplococcus magnus.3
F magna è probabilmente il più comune di tutti i cocchi anaerobici gram-positivi (GPAC) e la forma più patogena trovata nei campioni clinici umani. Questo microrganismo fa parte del normale biota e si trova prevalentemente nella pelle, nel tratto gastrointestinale, nel tratto genitourinario femminile e, in misura minore, nella cavità orale.1,2 Negli ultimi anni sono state identificate 2 importanti proteine che spiegano la virulenza e la capacità di colonizzazione di F magna: la proteina di adesione superficiale FAF (F magna adhesion factor) e la serina proteasi simile alla subtilisina SufA.2,4 Negli strati superiori dell’epidermide, il FAF media l’adesione legandosi alla galectina-7, un marcatore cellulare dei cheratinociti. Dopo che i batteri si muovono più in profondità nella pelle e raggiungono la membrana basale, SufA rompe il collagene IV. Nel derma, FAF interagisce con collagene V e fibrillina, che presumibilmente spiega come F magna può raggiungere gli strati più profondi del tessuto dermico durante l’infezione.5
F magna è una delle specie più comunemente coltivate da ascessi della pelle, dei tessuti molli, delle ossa e delle articolazioni, di solito in colture polimicrobiche e in rari casi in colture pure.3 Sono state descritte mediastinite postoperatoria, endocardite della valvola protesica e polmonite necrotizzante dovuta a F magna.6 L’uso di antibiotici ad ampio spettro che alterano il microbiota cutaneo, l’introduzione di materiali estranei (valvole protesiche, articolazioni sostitutive, cateteri) e un aumento del numero di pazienti trattati con farmaci immunosoppressori favoriscono queste infezioni creando un ambiente ottimale per questi patogeni opportunisti.
La resistenza antimicrobica tra i batteri anaerobici è in aumento in tutto il mondo.7 La maggior parte dei GPAC (> 90%) sono suscettibili alla penicillina e molti sono anche sensibili ad altri antibiotici β-lattamici, 7-10 ma mostrano una crescente resistenza ad altri antibiotici come clindamicina,metronidazolo e fluorochinoloni.8-10 Tassi di resistenza alla clindamicina tra GPAC vanno dal 7% al 20%, ma sono in aumento in alcune specie, tra cui le specie F magna e Peptoniphilus.7 La maggior parte dei GPAC è ancora suscettibile al metronidazolo, sebbene siano stati descritti alcuni ceppi resistenti al metronidazolo di F magna e Parvimonas micra.9
Il caso in esame illustra come il batterio commensale F magna sia in grado di produrre un’infezione necrotizzante avanzata e sottolinea l’importanza dell’identificazione a livello di specie e della determinazione della sensibilità antimicrobica dei batteri anaerobici da campioni rappresentativi quando isolati in colture pure.
Conflitti di interesse
Gli autori dichiarano di non avere conflitti di interesse.