Fare l’anello aromatico disponibile per l’attacco da nucleofili
la Maggior parte delle preparazioni di composti aromatici che abbiamo visto (come la sostituzione elettrofila aromatica nei, così come la Suzuki reazione coperto nella sezione precedente) comportano l’anello aromatico come nucleofilo, reagendo con un reagente elettrofilo. Sostituzione aromatica nucleofila (in 17.1.) coinvolge reagenti nucleofili, ma è limitato agli anelli con forti gruppi di ritiro degli elettroni orto o para a un gruppo di partenza. Il modo più versatile per rendere disponibili anelli aromatici per l’attacco nucleofilo è preparare sali di arenediazonio, contenenti lo ArN ArN2+. Lo schema seguente mostra la varietà di reazioni possibili con i sali di arenediazonio.

I sali di arenediazonio sono facilmente preparati da arilammine (aniline) usando un processo chiamato diazotizzazione. Il processo prevede la dissoluzione dell’ammina in un acido adatto, il raffreddamento in un bagno di ghiaccio a 0-5 oC, quindi l’aggiunta di nitrito di sodio (NaNO2) soluzione. L’acido reagisce con il NaNO2 per formare acido nitroso (HNO2), che poi reagisce con l’arilammina per formare il sale di arenediazonium. Il sale più comune da usare per queste reazioni è il cloruro (fatto usando HCl come acido), che sono abbastanza solubili ma si decompongono rapidamente a temperatura ambiente. Tuttavia, in alcune reazioni (come la formazione di fenoli) lo chloride cloruro può interferire e sostituire un Cl, quindi in quei casi viene utilizzato il solfato (realizzato con H2SO4). I solfati di diazonio sono un po ‘ più stabili dei cloruri, ma sono anche generalmente meno solubili e quindi più scomodi da usare. I tetrafluoroborati di diazonio sono costituiti da cloruri aggiungendo HBF4; di solito sono completamente insolubili, il che consente loro di essere filtrati, quindi essiccati per la decomposizione senza acqua presente per introdurre un fluoro sull’anello. Questo metodo per introdurre fluoro su un anello aromatico è chiamato reazione di Balz-Schiemann.
I sali di Arenediazonium sono intermedi utili e facilmente perdono l’azoto reagiscono con una varietà di nucleofili, come mostrato nello schema sopra. Poiché l’azoto è molto stabile e viene perso come gas, questo fornisce una potente forza trainante per queste reazioni. Nel caso dell’acqua o dello ion ioduro, il nucleofilo reagisce senza bisogno di alcuna catalisi. Tuttavia, molte reazioni di sali di diazonio sono catalizzate dal rame(I), nel qual caso la reazione viene definita reazione di Sandmeyer.
Una reazione che trattiene i due nitrogeni comporta l’accoppiamento con un altro anello aromatico (ricco di elettroni), come mostrato nella parte sinistra dello schema di reazione. Questo è molto importante nell’industria dei coloranti artificiali, che è stata principalmente stabilita utilizzando la produzione di questi “coloranti azoici” dopo la scoperta del malva di Perkin nel 1856.
Uso in sintesi
La chimica dei sali di diazonio, basata su reagenti nucleofili utilizzati con un anello aromatico elettrofilo, è complementare alla sostituzione aromatica elettrofila (EAS, che utilizza reagenti elettrofili). I sali di diazonio sono facilmente preparati dagli aromatici tramite una sintesi in tre fasi:

Se sono necessari altri sostituenti, questi possono essere introdotti durante la sintesi. Se è necessario un meta sostituente, il sostituente viene introdotto allo stadio nitro o prima; per i sostituenti orto/para, questo può essere fatto allo stadio NH2. Il gruppo amminico in un’arilammina (anilina) è un attivatore molto potente, quindi molte reazioni EAS di arilammine introducono rapidamente 2 o 3 sostituenti a meno che la reattività del gruppo NH2 non sia moderata dalla formazione di un’ammide – ricordiamo questo metodo per la protezione delle ammine tramite acetilazione, dal capitolo 16. In alcuni casi, il nuovo sostituente può anche essere ridotto durante la riduzione del gruppo nitro, come in questa sintesi di cloruro di meta-propilbenzenediazonio dal benzene:
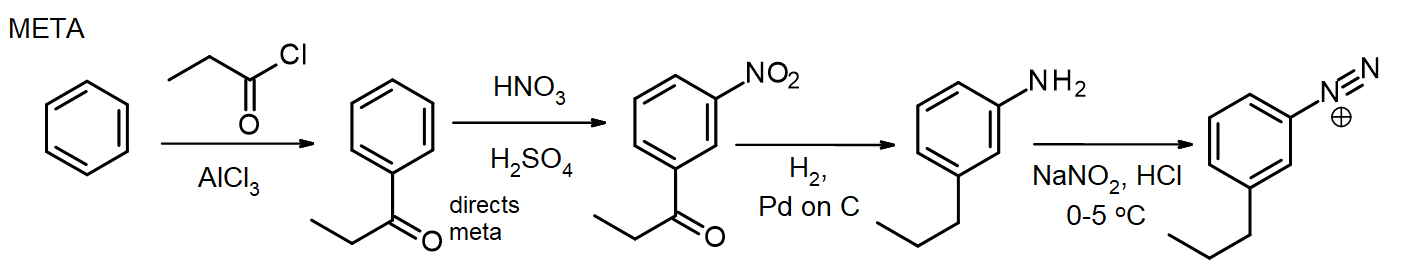
Per la sintesi dell’isomero para, l’arilammina viene acetilata prima della reazione di Friedel-Crafts, quindi deacetilata riscaldando con eccesso di aq. HCl subito prima della diazotizzazione.

Questa sintesi para isomero mostra l’uso del gruppo acetile per controllare la reattività del gruppo amminico. (Una sintesi alternativa potrebbe evitare questo introducendo il gruppo propilico prima, prima della nitrazione.) Sebbene queste sintesi sembrino lunghe, implicano passaggi sintetici affidabili e riproducibili e seguono uno schema standard. Inoltre, il fatto che diversi sostituenti possano essere introdotti in posizioni selezionate lungo il percorso rende questo approccio una sequenza sintetica molto preziosa.