설명
벤젠은 염소 및 브롬과 같은 할로겐(염전)과 반응하고 이러한 반응은 염화 알루미늄,이염화황,이염화 철 또는 철과 같은 루이스 산의 촉매 존재 하에서 친 전자 성 치환 반응이라고합니다. 알루미늄 평범한 사람은 때 벤젠 반작용 평범한 사람 이용됩니다.철은 소량의 염소 오르브로민과 반응하여 철(3)클로라이드 펙 3 또는 철(3)브로마이드 페브 3 을 형성하기 때문에 촉매가 아닙니다.염소와의 반응 염화알루미늄 또는 철의 존재 하에서 염소와 반응하여 클로로벤젠을 제조한다.벤젠은 브롬화 알루미늄 또는 철의 존재 하에서 브롬과 반응하여 브롬화 벤젠을 생성한다. 철 쉽게 사용할 수 있고 저렴 하기 때문에 사용 됩니다.
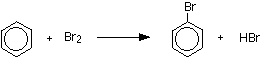
추가 반응
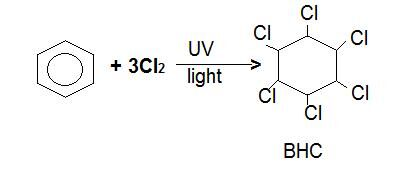
추가염소 또는 브롬과 자외선의 존재 하에서 뜨거운 벤젠의 반응이 일어난다. 염소 또는 브롬 원자가 탄소 원자와 고리에 추가됩니다.지역화가 영구적으로 끊어집니다.
예:1,2,3,4,5,6-헥사 클로로 시클로 헥산은 뜨거운 벤젠을 통해 염소 가스가 1 시간 동안 자외선에 노출 될 때 생성됩니다.
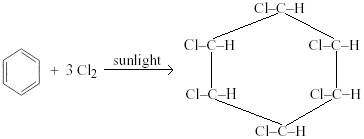
브롬은 유사하게 행동 할 것이고,염소와 수소는 고리의 임의의 위치에서 위아래로 튀어 나와 이성질체의 수를 만든다. 탄소-탄소 이중 결합이 깨져서 회전 할 수 없습니다. 다른 이성질체는 일반적으로 다음과 같이 불리는 살충제로 사용됩니다. 또한 불린 염화 탄화수소 그것은 환경에 아주 유해합니다..
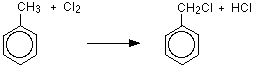
메틸 벤젠의 할로겐화
치환 반응
메틸 벤젠과 염소 또는 브롬 사이의 치환 반응은 두 가지 방법으로 일어난다:
- 링으로 치환
- 메틸기로 치환
링으로 치환
이반응은 실온에서 염화알루미늄 또는 철의 존재 및 자외선의 부재 하에서 수행된다. 메틸기는 링의 2 또는 4 위치에 부착되고,새로운 그룹은 그 옆의 링에 부착된다.메틸기. 염소와의 치환 반응은 두 가지 생성물을 생성한다.2-클로로 메틸 벤젠 및 4-클로로 메틸 벤젠.2018 년 11 월 1 일(토)~11 월 1 일(일)~11 월 1 일(일)~11 월 1 일(일)~11 월 1 일(일)
메틸기로 치환
메틸기에 있는 염소 또는 브롬의 치환은 자외선의 면전에서 그리고 촉매 부재에서 메틸벤젠을 비등하는 고리 보다는 오히려.
형성된 제품은(클로로 메틸)벤젠이며,부류로 작성된 이름은 염소가 메틸기에 부착되고 고리가 아닌 것을 나타낸다.
수소 원자는 염소 원자에 의해 메틸기에서 대체되고,메틸기에 있는 모든 3 개의 수소 원자는 염소 원자에 의해 대체된다. 새로운 제품은(디클로로 메틸)벤젠 및(트리클로로 메틸)벤젠 수소 원자가 한 번에 하나씩 교체되기 때문입니다.
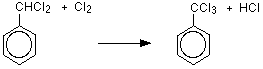
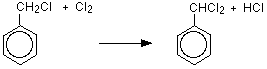
친전 살의 형성
고리 내의 전자의 탈 국소화는 염소-염소 결합을 격퇴하므로 염소 분자가 벤젠 고리에 접근한다.
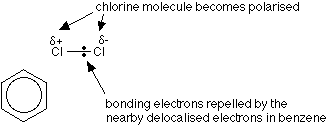
양극화 된 알루미늄 염화물 도움,염소 분자의 긍정적 인 끝은 다음과 같이 작용합니다.친전.
친 전자성 치환 메커니즘
1 단계
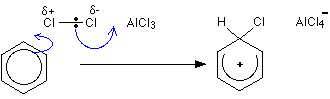
두 번째 단계
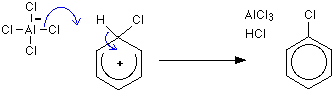
1 단계 수소는 알클 -4 이온을 통해 제거되지만 2 단계 염화 알루미늄이 재생됩니다.
벤젠의 염소화 메커니즘
첫 번째 단계:
염소는 루이스 산과 반응하여 염소를보다 친전 사적으로 만드는 복합체를 형성합니다.
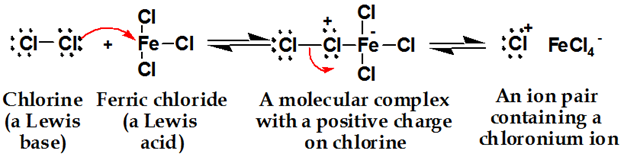
두 번째 단계:
링에 클로로늄 이온 공격. 방향족 씨=씨의 이중 결합 전자는 친핵체로서 작용하여 친 전자 성 씨엘을 공격하고 탈 국소화가 일어난다.
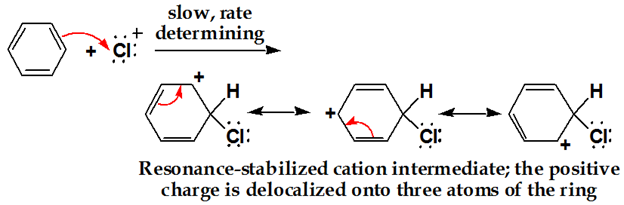
세 번째 단계:
양성자 전달은 고리의 방향족 특성을 재생합니다.
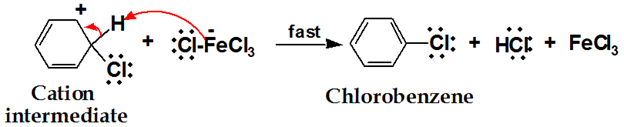
클로로 벤젠은
- 을 사용합니다.황산의 존재 하에서 염소와의 반응의 도움으로 농약 생산에 사용됩니다.
- 그것은 제초제,염료 및 고무와 같은 상품의 준비에서 중간체로 사용됩니다.
- 그것은 또한 접착제,페인트,페인트 제거제,광택제,염료 및 약물의 제조를위한 고비등 용매로 사용됩니다.
- 그것은 또한 폴리우레탄 절연제의 준비를 위해 사용됩니다.
건강 문제
높은 수준의 경험에 노출 된 사람 두통,마비,졸음,메스꺼움 및 구토. 클로로 벤젠은 또한 많은 부분의 기능 저하에 영향을 미칩니다.신경계. 가벼운 동물에서 심한 노출은 뇌,간 및신장. 또한 선천적 결함을 유발합니다.