waardoor de aromatische ring beschikbaar is voor nucleofielen
de meeste preparaten van aromatische verbindingen die we hebben gezien (zoals elektrofiele aromatische substitutie, evenals de Suzuki-reactie die in het vorige hoofdstuk werd behandeld) betrekken de aromatische ring als nucleofiel en reageren met een elektrofiele reagens. Nucleofiele aromatische substitutie (in 17.1.) omvat nucleofiele reagentia, maar het is beperkt tot ringen met sterke elektron-terugtrekkende groepen ortho of para tot een verlaten groep. De meest veelzijdige manier om aromatische ringen beschikbaar te maken voor nucleofiele aanval is het bereiden van arenediazoniumzouten, die het ArN2+ – ion bevatten. Het onderstaande diagram toont de verscheidenheid aan reacties die mogelijk zijn met arenediazoniumzouten.

Arenediazoniumzouten worden gemakkelijk bereid uit arylamines (anilines) met behulp van een proces dat diazotisatie wordt genoemd. Het proces impliceert het oplossen van de amine in een geschikt zuur, het koelen in een ijsbad aan 0-5 oC, dan het toevoegen van natriumnitriet (NaNO2) oplossing. Het zuur reageert met NaNO2 om salpeterzuur (HNO2) te vormen, dat dan met arylamine reageert om het arenediazoniumzout te vormen. Het meest voorkomende zout om te gebruiken voor deze reacties is het chloride (gemaakt met behulp van HCl als zuur), die vrij oplosbaar zijn, maar snel ontbinden bij kamertemperatuur. Echter, in sommige reacties (zoals fenolvorming) kan het chloride-ion interfereren en een Cl vervangen, dus in die gevallen wordt het Sulfaat (gemaakt met behulp van H2SO4) gebruikt. Diazoniumsulfaten zijn iets stabieler dan chloriden, maar ze zijn over het algemeen ook minder oplosbaar en dus lastiger in gebruik. Diazoniumtetrafluorboraten worden gemaakt van chloriden door toevoeging van HBF4; ze zijn meestal volledig onoplosbaar, waardoor ze kunnen worden gefilterd en vervolgens gedroogd voor ontbinding zonder water aanwezig om een fluor in de ring. Deze methode om fluor in een aromatische ring te brengen wordt de Balz-Schiemann-reactie genoemd.
Arenediazoniumzouten zijn nuttige tussenproducten, en zij verliezen gemakkelijk stikstof met een verscheidenheid aan nucleofielen, zoals in het bovenstaande diagram wordt getoond. Aangezien stikstof zeer stabiel is en als gas verloren gaat, biedt dit een krachtige drijvende kracht voor deze reacties. In het geval van water of jodide-ion reageert het nucleofiel zonder katalyse. Echter, veel reacties van diazoniumzouten worden gekatalyseerd door koper (I), in welk geval de reactie wordt aangeduid als een Sandmeyer-reactie.
een reactie die de twee nitrogenen vasthoudt, wordt gekoppeld aan een andere (elektronenrijke) aromatische ring, zoals aangegeven in het linker deel van het reactieschema. Dit is zeer belangrijk in de kunstmatige kleurstofindustrie, die voornamelijk werd opgericht met behulp van de productie van deze “azokleurstoffen” na de ontdekking van Perkin ‘ s mauve in 1856.
gebruik in synthese
diazoniumzout chemie, gebaseerd op nucleofiele reagentia gebruikt met een elektrofiele aromatische ring, is complementair aan elektrofiele aromatische substitutie (EAS, dat gebruik maakt van elektrofiele reagentia). Diazoniumzouten worden gemakkelijk bereid uit aromaten via een driestapssynthese:

als andere substituenten nodig zijn, kunnen deze tijdens de synthese worden geïntroduceerd. Als een meta-substituent nodig is, wordt de substituent in of voor het nitro-Stadium geïntroduceerd; voor ortho/para-substituenten kan dit in het NH2-stadium worden gedaan. De aminogroep in een arylamine (aniline) is een zeer krachtige activator, zo veel EAS reacties van arylamines snel introduceren 2 of 3 substituenten tenzij de reactiviteit van de NH2 – groep wordt gematigd door de vorming van een amide-herinner deze methode voor bescherming van amines via acetylering, uit hoofdstuk 16. In sommige gevallen kan de nieuwe substituent ook worden verminderd tijdens de reductie van de nitrogroep, zoals bij deze synthese van Meta-propylbenzeendiazoniumchloride uit benzeen:
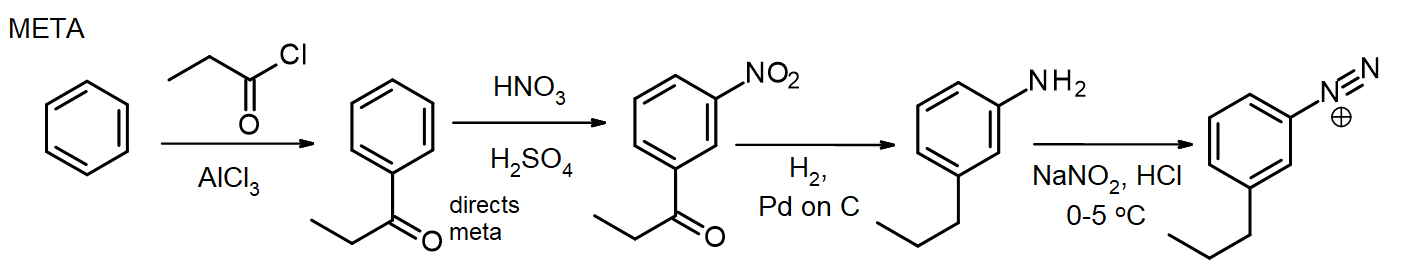
voor de synthese van het para-isomeer wordt de arylamine geacetyleerd vóór de Friedel-Crafts-reactie en vervolgens gedeacetyleerd door verhitting met een teveel aan aq. HCl vlak voor diazotisatie.

deze para-isomeersynthese toont het gebruik van de acetylgroep om de reactiviteit van de aminogroep te controleren. (Een alternatieve synthese zou dit kunnen voorkomen door eerst de propylgroep in te voeren, vóór nitratie. Hoewel deze syntheses lang lijken te zijn, gaan ze gepaard met synthetische stappen die betrouwbaar en reproduceerbaar zijn, en ze volgen een standaardpatroon. Ook het feit dat verschillende substituenten kunnen worden geïntroduceerd op geselecteerde posities langs de weg maakt deze aanpak een zeer waardevolle synthetische sequentie.