Fazer o anel aromático disponível para o ataque por nucleophiles
a Maioria das preparações de compostos aromáticos, temos visto (como electrophilic aromáticos de substituição, bem como a reação de Suzuki abordado na seção anterior) envolvem o anel aromático como nucleophile, reagindo com uma electrophilic reagente. Substituição aromática nucleofílica (em 17.1.) involves nucleophilic reagents, but it is limited to rings with strong electron-retiring groups Orto or para to a leaving group. A maneira mais versátil de fazer anéis aromáticos disponíveis para ataque nucleofílico é preparar sais de arenediazônio, contendo o íon ArN2+. O diagrama abaixo mostra a variedade de reações possíveis com sais de arenediazônio.

os sais de Arenediazónio são facilmente preparados a partir de arilaminas (anilinas) utilizando um processo chamado diazotização. O processo envolve a dissolução da amina em um ácido adequado, resfriando em um banho de gelo a 0-5 oC, em seguida, adicionando a solução de nitrito de sódio (NaNO2). O ácido reage com o NaNO2 para formar ácido nitroso (HNO2), que então reage com a arilamina para formar o sal de arenediazônio. O sal mais comum a usar para estas reações é o cloreto (feito usando HCl como o ácido), que são bastante solúveis, mas se decompõem rapidamente à temperatura ambiente. No entanto, em algumas reações (como a formação de fenol) o íon cloreto pode interferir e substituir um Cl, então nesses casos o sulfato (feito usando H2SO4) é usado. Sulfatos de diazônio são um pouco mais estáveis do que cloretos, mas também são geralmente menos solúveis e, portanto, mais difíceis de usar. Tetrafluoroboratos de diazônio são feitos de cloretos adicionando HBF4; eles são geralmente completamente insolúveis, o que permite que eles sejam filtrados, então secos para decomposição sem água presente para introduzir um flúor no anel. Este método para introduzir flúor em um anel aromático é chamado de reação de Balz-Schiemann.
os sais de Arenediazónio são intermediários úteis, e facilmente perdem reacção nitrogenada com uma variedade de nucleófilos, como mostrado no diagrama acima. Uma vez que o nitrogênio é muito estável, e é perdido como um gás, isso fornece uma força motriz poderosa para estas reações ocorrerem. No caso de íon de água ou iodeto, o nucleófilo reage sem necessidade de qualquer catálise. No entanto, muitas reações de sais de diazônio são catalisadas pelo cobre (I), caso em que a reação é referida como uma reação de Sandmeyer.
uma reação que retém os dois nitrogénios envolve o acoplamento a outro anel aromático (rico em elétrons), como mostrado na parte esquerda do esquema de reação. Isto é muito importante na indústria de corantes artificiais, que foi estabelecida principalmente usando a produção destes “corantes azo” após a descoberta da mauve de Perkin em 1856.
utilização em síntese
a química do sal de Diazónio, baseada em reagentes nucleofílicos utilizados com um anel aromático electrofílico, é complementar à substituição electrofílica aromática (EAS, que utiliza reagentes electrofílicos). Os sais de diazónio são facilmente preparados a partir de aromáticos através de uma síntese em três fases.:

se forem necessários outros substituintes, estes podem ser introduzidos durante a síntese. Se um meta-substituinte é necessário, o substituinte é introduzido em ou antes da fase nitro; para substituintes orto/para, isso pode ser feito na fase NH2. O grupo amino em uma arilamina (anilina) é um ativador muito poderoso, tantas reações EAS de arilaminas rapidamente introduzem 2 ou 3 substituintes, a menos que a reatividade do grupo NH2 seja moderada pela formação de um amida – recordar este método para a proteção das aminas via acetilação, a partir do Capítulo 16. In some cases, the new substituent may also be reduced during the reduction of the nitro group, as in this synthesis of meta-propylbenzenodiazonium chloride from benzene:
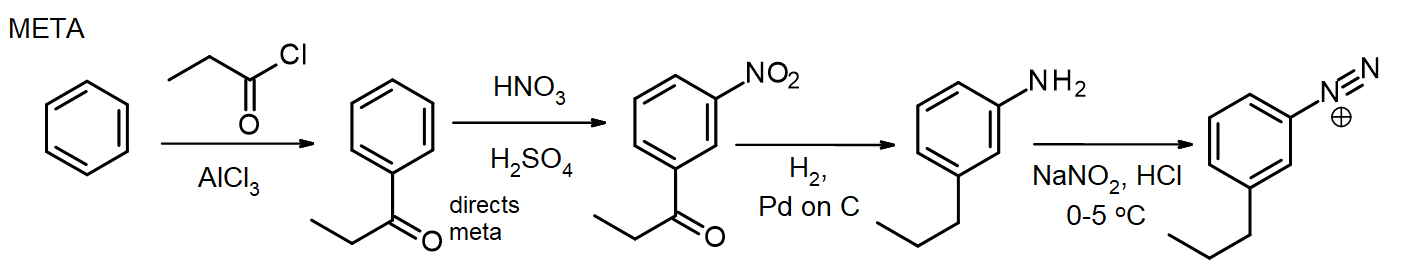
para a síntese do isômero para, a arilamina é acetilada antes da reação de Friedel-Crafts, então desacetilada por aquecimento com excesso de aq. HCl mesmo antes da diazotização.

esta síntese de isômero para mostra o uso do grupo acetilo para controlar a reatividade do grupo amino. (An alternative synthesis could avoid this by introducing the propyl group first, before nitration.) Embora estas sínteses pareçam ser longas, elas envolvem passos sintéticos que são confiáveis e reprodutíveis, e seguem um padrão padrão. Além disso, o facto de diferentes substituintes poderem ser introduzidos em posições seleccionadas ao longo do caminho torna esta abordagem uma sequência sintética muito valiosa.